微信复制原名:Naturalrevegetation over 160 years alters carbon and nitrogen sequestrationand stabilization in soil organic matter on the Loess Plateau ofChina
译名:160多年的自然植被恢复改变了黄土高原土壤有机质碳氮的固存和稳定
作者:WenYang
期刊:CATENA
影响因子/分区:6.367/Q1
发表时间:2022.09.29
13C和15N、C和N稳定、密度和粒度分馏、矿物伴生有机质、植被恢复
(1)背景:自然植被恢复下植物的功能性状,以及植物的组成、结构、盖度和植被群落的生物多样性发生了很大变化。这些调整改变了进入土壤的植物残渣的数量和质量、土壤的物理化学属性、土壤水分模式和土壤微生物数量。最终,这些因素会极大地影响生态系统中的C和N循环,特别是在土壤C和N的固存方面。
自然植被恢复通过促进植物和土壤中的碳和氮的吸收被认为是减缓气候变化的一种有前途的途径。然而自然植被恢复是如何稳定土壤有机质(SOM)中的C和N的,目前还不清楚。SOM中C和N的物理化学稳定性以及有机质(OM)的组成在决定陆地生态系统中C和N的持久性方面起着至关重要的作用。阐明自然植被如何影响土壤表层碳、氮的固存和稳定,对于估算土壤碳、氮的长期获取和储存及其对气候变化的影响至关重要。
(2)主题:本研究将土壤物理分馏过程与稳定同位素分析相结合,分析了SOM、FLF、IPOM和MAOM中的有机C和TN浓度和储量、C:N比值以及δ13C和δ15N值。此外,我们检测了土壤微生物生物量C和N(MBC和MBN)的浓度,土壤理化属性,即土壤pH值、湿度和体积密度(BD),以及在不同土壤深度(0-20、20-40和40-60cm)和不同恢复阶段(农田、先锋杂草、草本植物、灌木到早期森林,最后到顶极林)的植物特征(即凋落物/根生物量、凋落物C:N比)
(1)长期的自然植被恢复增加了SOM及其组分中C、N的固存,其中顶极林在SOM及其组分中C、N的固存量最大;
(2)长期自然植被恢复通过将C和N向非保护和纯物理保护的SOM组分转移,改变了SOM中C和N的稳定性,并相应地减少了最稳定的MAOM中C和N的分配;
(3)SOM及其组分的δ13C和δ15N值随长期自然植被恢复而变化。土壤有机质中δ13C和δ15N值最丰富的是农田。
(1)本次调查在中国陕西省福县黄土高原中部地区的子午岭进行,该地区土壤疏松,人为干扰不断,水土流失严重,自然植被恢复了废弃的农田,在过去的约160年里,人们观察到了不同的植被恢复阶段,从先锋杂草到草本植物,到灌木,再到早期和顶极森林。
选取了6个典型的自然植被恢复阶段为研究样本:
(1)农田阶段(对照,0年,FS);
(2)杂草先驱期(约15年,PWS);
(3)草本期(30年,HS);
(4)灌木期(约50年,SS);
(5)早期林期(110年,EFS);
(6)林顶期(160年,CFS)。
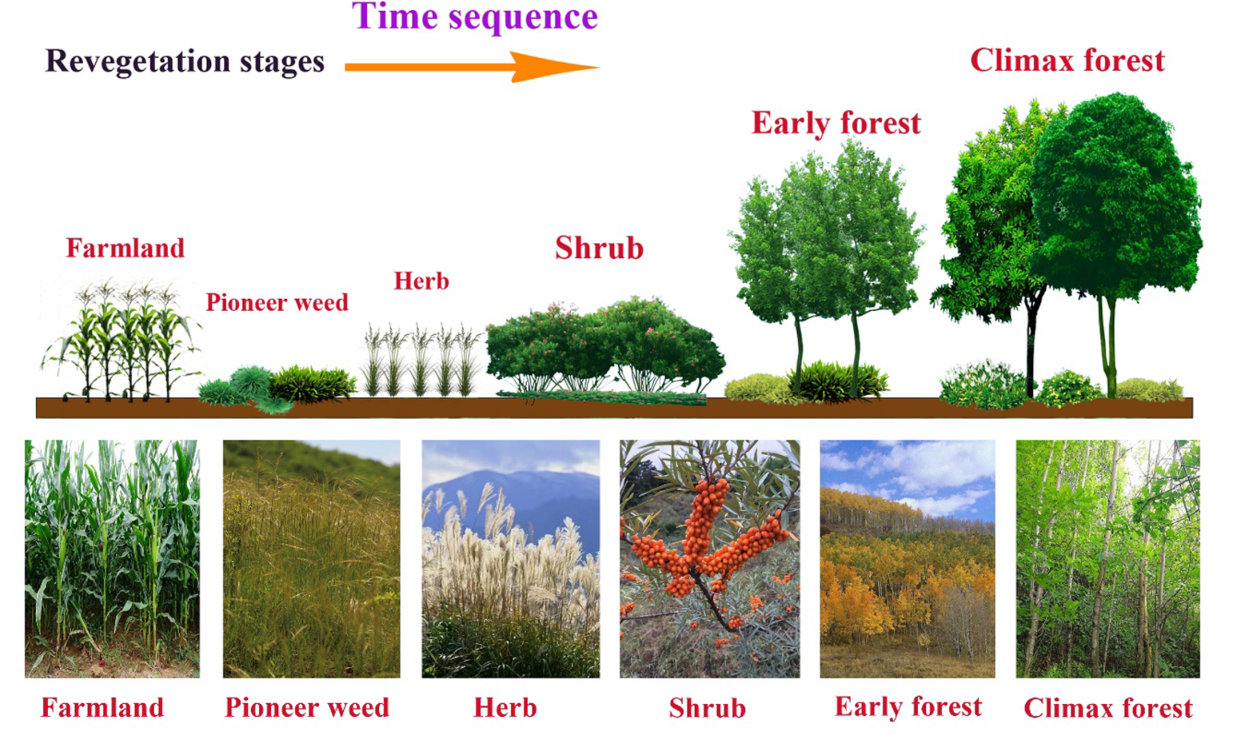
图1
(2)于2019年10月采集样本,每个植被恢复阶段随机建立4个重复小区。采用s型取样技术,分别在0-20、20-40和40-60cm深度的每个地块随机抽取9个土壤样品(5cm直径×20 cm深)。在0-20、20-40和40-60cm土壤深度使用切割环确定每个地块的容土密度。每个小区随机选取3个1× 1 m样方进行凋落物采样。分别在土壤深度0-20、20-40、40-60cm处,用根钻随机抽取3个根样芯(直径10cm× 20cm深)。
(3)土壤样品清除所有根系和有机碎片,然后通过2mm筛和完全混合,分离出三个子样品。第一个子样品在105◦C恒重干燥,第二个子样品在环境空气中干燥,并过1毫米筛,第三个子样品在环境空气中干燥,并过2毫米筛,以确定SOM、FLF和IPOM中的C和N浓度。用切割环提取的新鲜土和固体土芯被加热到105◦C和干燥到一个均匀的重量,分别量化土壤水分和容重。用pH计测定土壤pH值。MBC和MBN浓度用氯仿熏蒸-萃取技术定量。清洗凋落物和根系样本,并烘干,分别测量凋落物和根系的生物量。
(4)为了实现功能上完全不同的SOM池,通过结合密度和尺寸分馏来分离土壤样品。将风干的样品放入离心管中,加入NaI溶液,然后塞管,振荡离心。用尼龙膜将浮在NaI上清液上的FLF用玻璃真空过滤装置分离。然后用CaCl2清洗残留在过滤器上的物质,以去除任何残留的NaI,然后清洗。用NaI提取离心管中漂浮的材料两次,并将这两个亚组分转移到玻璃烧杯中,在50◦C下加热和干燥,称重创建FLF样品。离心瓶底部残留的土壤漂洗2次,离心,取上清。将洗净的土壤样品分散在SHMP中,土壤悬浮液过筛分离IPOM和MAOM。获得的IPOM和MAOM样品干燥并称重。
(5)为了去除全部无机C,将通过土壤分馏过程获得的大块土壤(即整个SOM)、FLF、IPOM和MAOM组分置于1M HCl室温下24小时。将烤箱干燥的SOM组分在球磨机中粉碎,制备有机C和TN浓度,并进行C和N的同位素分析。使用VarioPYRO立方元素分析仪测量SOM组分和植物材料中的C和N浓度。平均而言,采用该分选方法后,土壤质量回收率为94.1%,C回收率为93.9%,N回收率为93.5%。使用IsoPrime100同位素比质谱仪对SOM馏分的稳定C和N同位素进行了评估。稳定的C和N同位素比值以δX(‰)表示:δX= [(RSAMPLE/RSTANDARD)−1]×1000‰每隔12个样品确定标准,δ13C和δ15N的重复测量精度分别为±0.15‰和±0.2‰。每个SOM组分的土壤C或N存储量(gm−2)由以下公式确定:土壤C或N存储量=Con. × BD × T × 10,其中Con.为每个SOM组分的有机C或TN浓度(gkg−1),T为土层厚度(cm)。
(6)采用单因素方差分析评价自然植被和土壤深度对土壤根系生物量、土壤pH、水分、BD、MBC、MBN、C和N浓度、SOM组分储量、SOM组分δ13C和δ15N值、SOM组分C和N分布比例以及SOM组分C:N比的影响。 采用单因素方差分析分析了自然植被对植被生物量、C、N含量和凋落物C:N比值的影响。 用邓肯检验评价各组平均值之间的显著差异(P<0.05)。采用双向方差分析研究了自然植被、土壤深度及其相互作用对土壤和植物属性、碳氮浓度、δ13C和δ15N以及SOM组分C:N比值的影响。 采用Pearson相关分析研究了SOM组分中C、N与植物土壤性质的关系。
(1)植物和土壤的特征
在0-20cm土层内,植被恢复阶段之间的农田、早期林和顶极林根系生物量最大。然而,20-60cm土层的根系生物量在植被恢复阶段之间没有显著变化。凋落物生物量随着自然植被的恢复逐渐增加,在顶极林达到最大值。植被恢复阶段之间,顶极林凋落物C:N比最大,农田最低。自然植被对根系生物量、土壤pH值、湿度、MBC和MBN有显著影响(表1)。随着自然植被的恢复,0-20cm土层pH值逐渐下降。土壤水分(0-20cm)以顶极林最高。植被恢复阶段之间,农田和草本植物的土壤BD(0 - 20 cm)最大。MBC和MBN(0 - 20cm)浓度随自然植被恢复而逐渐增加。土壤pH、水分、BD、MBC和MBN受到土壤深度的显著影响(表1)。在每个植被恢复阶段,土壤MBC和MBN浓度随土层深度的增加而下降。
(2)SOM组分的C、N浓度和存储量
自然植被恢复显著(P< 0.001)影响SOM、FLF和IPOM中的有机C和全N,而对MAOM中的有机C和全N无显著影响(P> 0.05)(表1)。在0-20cm土层中,顶极林和早期林的SOM、FLF和IPOM的有机C浓度和库存量均显著高于灌木、草本植物、先锋杂草和农田(表2,图2a、b、d)。0- 20 cm土壤中MAOM有机碳库存量在顶极林最大,在植被恢复期之间的草本期最小(图2c)。植被恢复阶段之间,顶极林中SOM(20 - 40 cm)、FLF和IPOM(20 - 60 cm)的有机C浓度和库存量最大(表2,图2a、b、d)。
顶极林和早期林的SOM总氮浓度和库存量、FLF(0 - 20 cm)的N库存量均显著高于其他植被恢复阶段(表2、图2e、h)。草本期和农田期IPOM(0 - 20 cm)的总氮浓度和库存量均显著低于其他植被恢复阶段(表2、图2f)。0- 20 cm土层中MAOM全氮浓度和库存量以顶极林最高,灌丛期最低(表2,图2g)。植被恢复阶段之间,顶极林20- 40 cm土层FLF和20- 60 cm土层IPOM的总N库存量最高(图2e,f)。
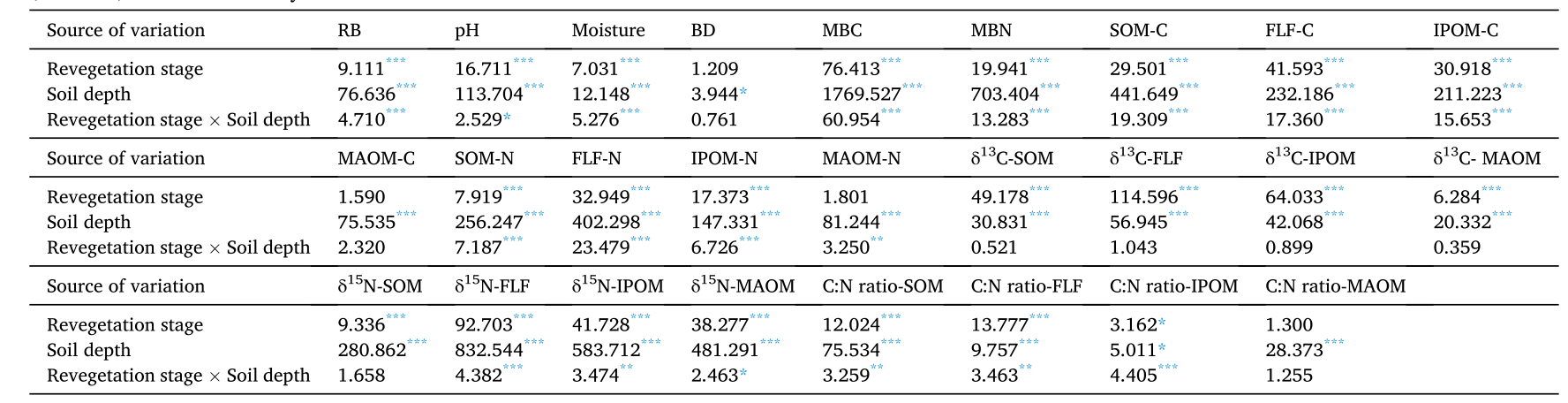
表1 基于双向方差分析,植被恢复阶段、土壤深度及其相互作用对SOM组分(0~ 60 cm)植物、土壤属性及C、N的影响具有统计学意义(F值、P值)。
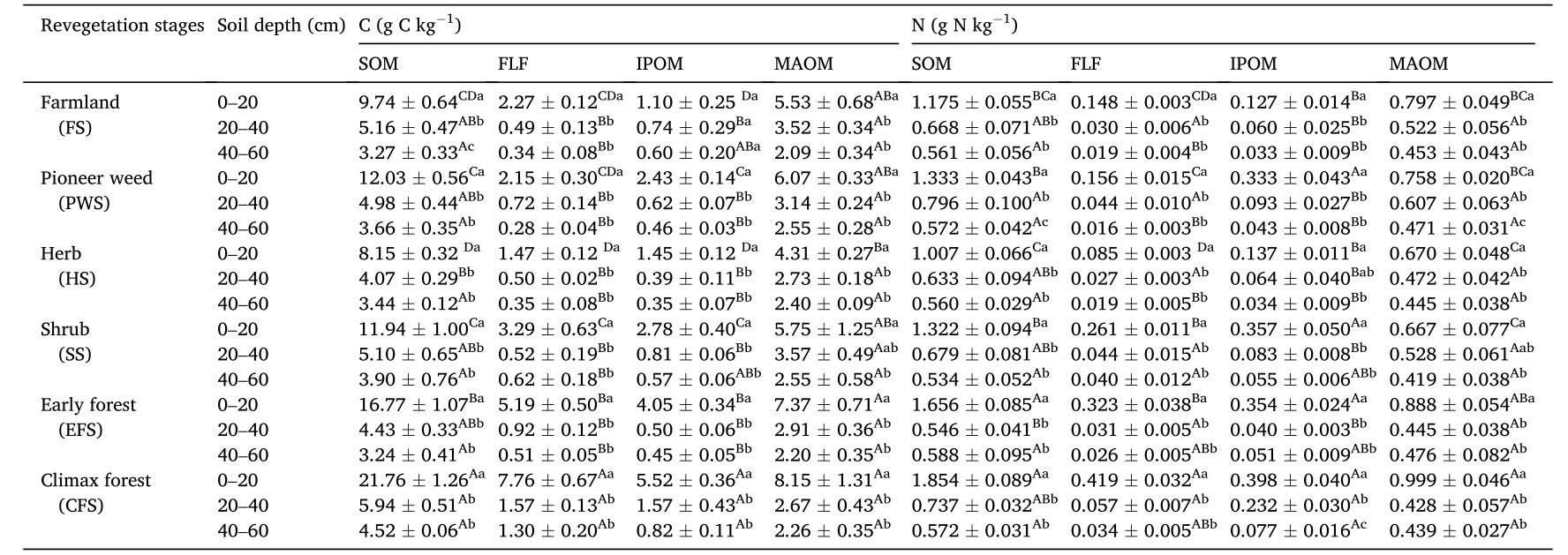
表2 黄土高原不同植被恢复阶段土壤有机质组分中有机碳和全氮的浓度(平均值±SE,N = 4)
不同上标大写字母表示同一土壤深度下不同植被阶段间差异有统计学意义(α= 0.05)。不同上标小写字母表示同一植被阶段土壤深度差异有统计学意义(α= 0.05)。
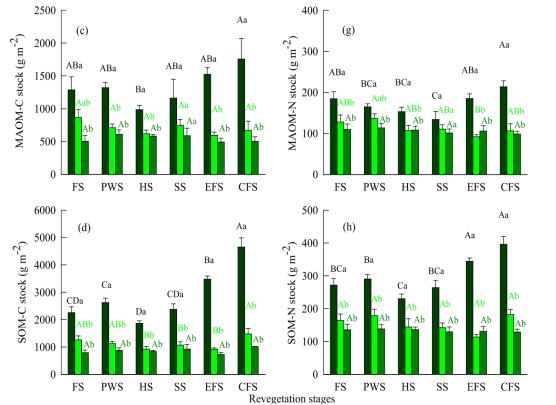
图2 黄土高原不同植被恢复阶段土壤有机质C和全氮储量(平均值±SE,N = 4)
不同上标大写字母表示同一土壤深度下不同植被阶段间差异有统计学意义(α= 0.05)。不同上标小写字母表示在同一植被恢复阶段不同土壤深度间差异有统计学意义。
FS:农田阶段;PWS:杂草先驱期;海关:草本阶段;SS:灌木阶段;EFS:早期森林阶段;CFS:顶级森林阶段。)
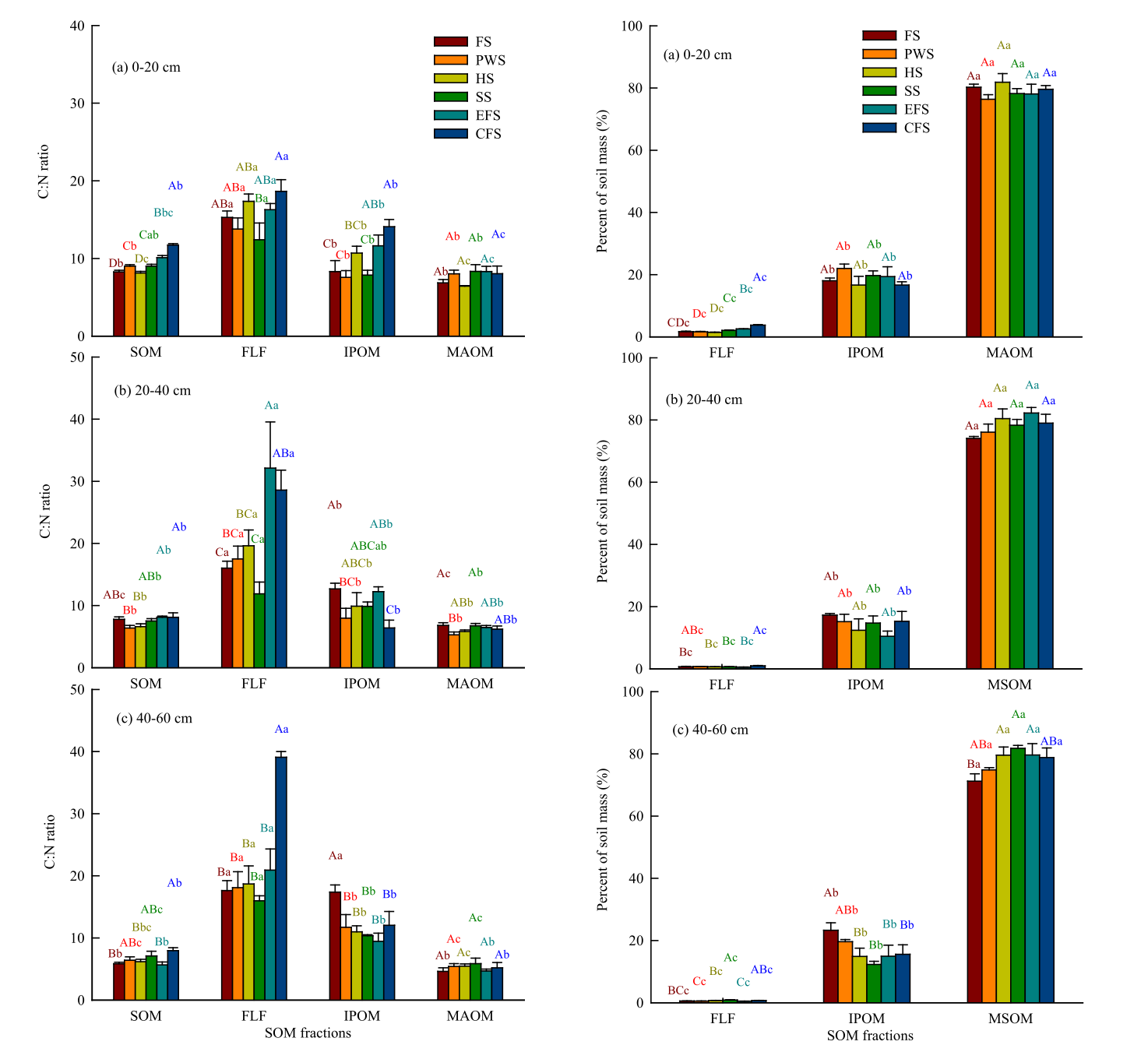
图3黄土高原不同植被恢复阶段SOM、FLF、IPOM和MAOM的C:N比值(均值±SE, N = 4)条形上的大写字母表示各土壤组分在α = 0.05水平上的植被恢复阶段差异有统计学意义。条形上的小写字母表示各植被恢复阶段SOM组分间的α = 0.05水平差异有统计学意义。 | 图4黄土高原不同植被阶段土壤(0 ~ 20、20 ~ 40和40 ~ 60 cm深度)中FLF、IPOM和MAOM的质量比(均值±SE, n = 4)。条形图上不同的大写字母表示各土壤组分在α = 0.05水平上的植被恢复阶段差异有统计学意义。条形图上不同小写字母表示各恢复阶段SOM组分间α = 0.05水平差异有统计学意义。 |
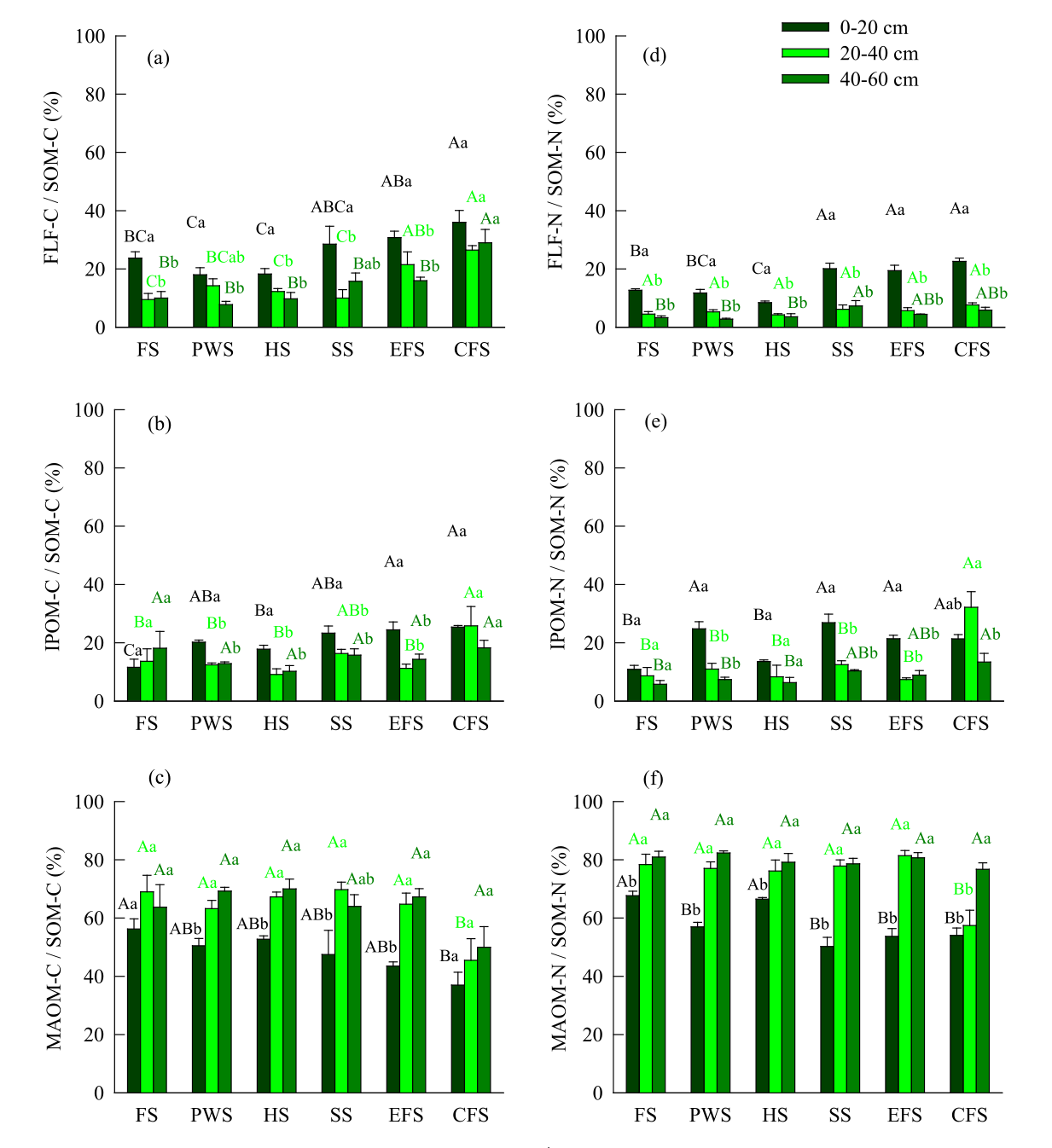
图5黄土高原不同植被恢复阶段FLF、IPOM和MAOM中C、N含量的分布比例(均值±SE,N = 15)不同上标大写字母表示同一土壤深度下不同植被阶段间差异有统计学意义(α= 0.05)。不同上标小写字母表示同一植被阶段土壤深度在α= 0.05水平上差异有统计学意义。
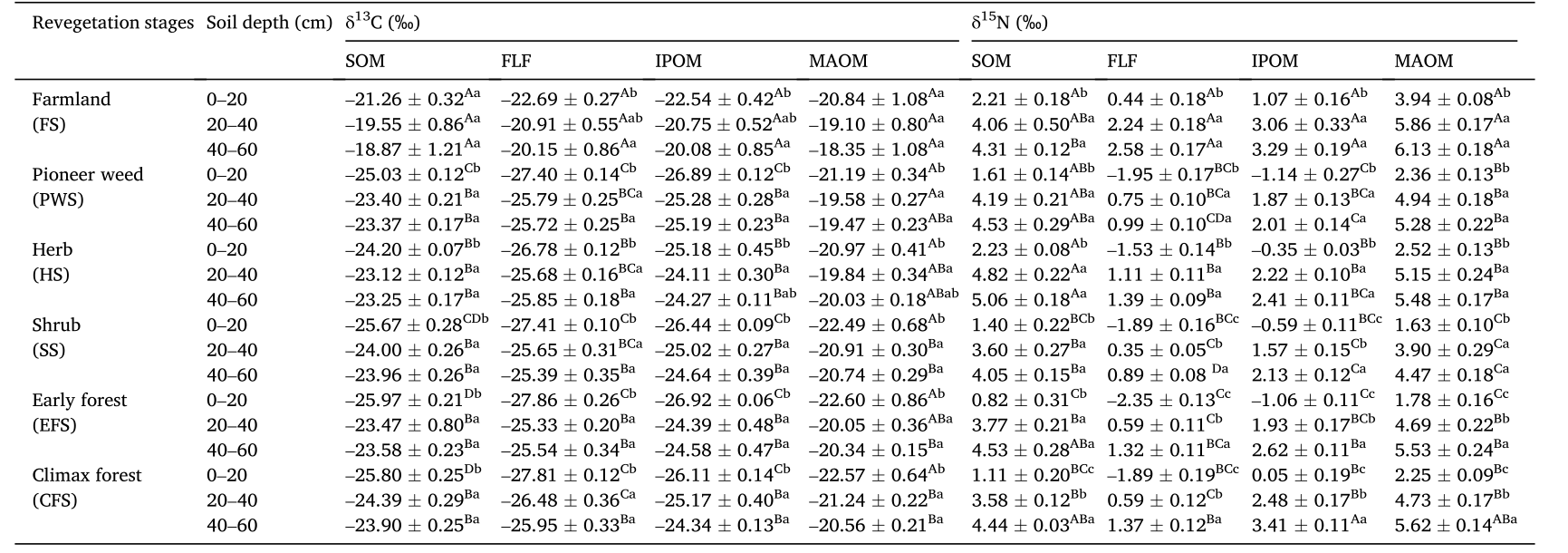
表3 黄土高原不同植被恢复阶段有机质组分δ13C(‰)和δ15N(‰)值
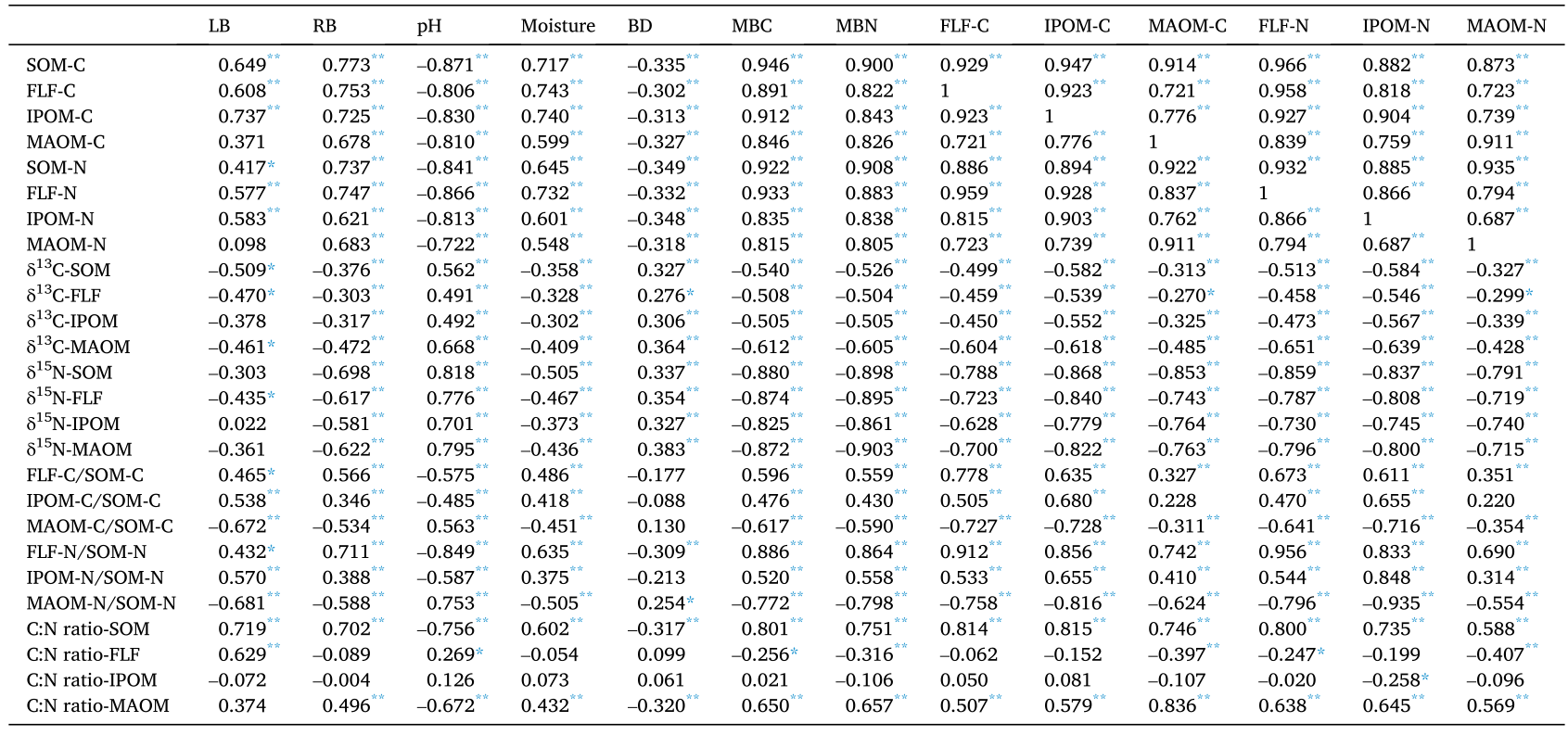
表4 黄土高原表层有机质中碳氮含量与0- 60 cm土壤性质的相关性分析
土壤深度对SOM、FLF、IPOM、MAOM有机碳和全氮浓度影响较大。0- 20 cm土层SOM、FLF、IPOM和MAOM的有机碳和全氮含量及库存量均显著高于20- 40和40- 60 cm土层,除农田的IPOM的有机碳浓度和库存量、灌丛的MAOM的有机碳和全氮库存量外。20-40cm和40-60cm土层有机质C和TN浓度以及SOM,FLF, IPOM, MAOM库存量差异不显著,例外情况极少。0-20cm土层SOM和IPOM的C:N比值,20- 60 cm土层SOM和FLF的C:N比值随自然植被的恢复逐渐增加(图3)。
(3)有机质组分中碳、氮的分布
0 -60 cm土层中FLF占土壤容重的0.49- 3.58%(图4);但各植被恢复阶段有机C含量占SOM(SOM-C)含量的7.75-36.00%,SOM(SOM-N)中总氮含量的2.76-22.57%(图5a和d)。0- 60 cm土层的IPOM占土壤容重的10.46- 23.31%(图4),分别占土壤SOM-C含量的9.11- 25.38%和SOM-N含量的5.78- 32.18%(图5b和e)。 随着自然植被恢复,0-20cm土层的FLF质量百分比逐渐升高(图4a)。随着自然植被的恢复,IPOM和MAOM质量(0-40cm)的百分比变化不大(图4a和b)。
0 -60cm土层的FLF-C/SOM-C和0-40cm土层的IPOM-C/SOM-C随自然植被恢复逐渐增加(图5a和b)。0-20cm土层的MAOM-C/SOM-C随自然植被恢复逐渐减少,(图5c)。0-20cm土层的FLF-N/SOM-N在顶极期、早期森林和灌木阶段显著大于草本、先锋杂草和农田阶段(图5d)。
(4)SOM的自然稳定同位素丰度分数
自然植被对SOM、FLF、IPOM、MAOM的δ13C和δ15N值有显著影响(表1),0- 60 cm土层SOM、FLF和IPOM的δ13C值在植被恢复阶段之间最大(表3)。0- 20 cm土层SOM的δ13C值在早林和顶极林中最低(表3)。顶级林和早期森林,灌木,草本和先锋杂草阶段的SOM、IPOM(20 - 60 cm)和FLF(40 - 60 cm) δ13C的消耗显著(P< 0.05)高于农田(表3)。MAOM(0 - 20 cm)的δ13C值随自然植被恢复变化不大(表3)。农田和草本阶段0- 20 cm土层的SOMδ13C含量显著(P<0.05)高于灌丛、早期和顶级林(表3)。此外,SOM、FLF、IPOM、MAOM的δ13C和δ15N值受土壤深度影响明显(表1)。
(5)将SOM馏分与植物和土壤特性联系起来
Pearson相关分析表明SOM、FLF、IPOM的C、N浓度、FLF-C/SOM-C、IPOM-C/SOM-C、FLF-N/SOM-N、IPOM-N/SOM-N、C:N比SOM、MBC、0~ 60 cm的MBN均与枯落物和根系生物量呈显著正相关(P< 0.05)(表4)。MAOM-c /SOM- c和MAOM-n /SOM- n与枯落物和根系生物量呈显著负相关(表4)。SOM、FLF、MAOM的δ13C值和FLF、MAOM-c /SOC、MAOM-n /SOM- n的δ15N值与枯落物生物量呈显著负相关(P<0.05)(表4)。各植被恢复阶段的MAOM-C/SOM-C、MAOM-N/SOM-N与根系生物量呈显著负相关(表4)。植被恢复各阶段SOM、FLF、IPOM和MAOM的C、N浓度以及SOM和MAOM的C:N比值之间呈极显著正相关(P< 0.01)。与土壤水分、MBC、MBN均呈极显著正相关,与土壤pH、BD呈极显著(P< 0.01)负相关(表4)。各植被阶段SOM、FLF、IPOM、MAOM的δ13C、δ15N值与土壤pH、BD呈极显著(P< 0.05)正相关;而与土壤湿度、MBC、MBN、SOM、FLF和IPOM的C、N浓度呈显著负相关(表4)。FLF-C/SOM-C、IPOM-C/SOC、FLF-N/SOM-N、IPOM-N/SOM-N与SOM、FLF和IPOM的土壤湿度、MBC、MBN、C、N浓度呈显著正相关,与土壤pH呈显著负相关(表4)。
自然植被显著促进黄土高原表层(0-20cm)土壤有机质及其组分中有机C和TN的积累(表2;图2)。表层土壤SOM及其组分中C、N的浓度和库存量在植被恢复后期(即早期和顶极林阶段)显著增加(表2;图2)。 顶极林表层土壤SOM中最大的C和N储量主要来自于FLF和IPOM中C和N的增加(图2)。总SOC池的增强主要来自于非受保护C的增加,FLF是非受保护OM,主要由未降解和部分腐烂的植物残体组成,包括凋落物和根物质的未附着颗粒、孢子和真菌菌丝。IPOM也主要由新的和部分腐烂的植物残体组成。然而,它受到土壤团聚体的物理保护。
在本研究中,凋落物和根系的生物量随自然植被的恢复而逐渐增强(表S2;图S1)。由此推断,大量增加的植物碎屑(即枯落物、根系等)是进入土壤的FLF和IPOM最重要的组成部分之一(表S2;图S1),这促进了植被恢复后期FLF、IPOM和大块SOM(0 - 20cm)中C和N的积累,特别是在顶极林(表2)。同时,顶极林表层土壤SOM中C和N储量的增加部分归因于MAOM中C和N的富集,尽管它们的增加储量远低于FLF和IPOM(图2)。Olayemi等人记录了MAOM随着IPOM分解的增强而增加。
此外,据报道,高质量的植物C输入,特别是来自根部碎屑和渗出物,为微生物提供了丰富的有效底物,促进了微生物的增殖和活性,从而增加了驱动MAOM形成的微生物副产物。在本研究中,根系生物量、MBC、MBN浓度、表层土壤IPOM浓度和库存量随着自然植被的恢复逐渐增加,在顶极林达到最大值(表2和表S2;图2)。结果显示,MAOM-C和MAOM-N与根系生物量、MBC、MBN、IPOM-c和IPOM-N呈强正相关关系(表4),而与凋落物生物量无相关性,这进一步支持了先前的研究,即MAOM独立于原始植物凋落物。我们推断,顶极林表层土壤中MAOM的最高C和N储量主要由推动MAOM形成的IPOM、微生物生物量(即MBC、MBN)和根系生物量的大幅增加所主导。
在整个土壤剖面上,SOM组分中的根系生物量、C和N储量随着土壤深度的增加而显著下降(表S2;图2),这与早期研究一致,表明SOM馏分中的C和N含量随着土壤深度的增加而下降。 平均而言,56%的根系生物量、70%的FLF-C、75%的FLF-N、65%的IPOM-C、64%的IPOM-N、51%的MAOM-C、44%的MAOM-N、58%的SOM-C和51%的SOM-N分配到不同植被恢复阶段的表层土壤(表S2);这表明,在不同植被恢复阶段,SOM组分中C和N的垂直分布主要集中在表层土壤。在每个植被恢复阶段,表层土壤SOM组分中C和N的分配高于深层土壤,这主要是由于覆盖表层土壤的凋落物层较厚,以及大部分根系物质分布在表层土壤中(表S2)。这些大量的植物残体进入表层土壤,在每个植被恢复阶段都极大地促进了表层土壤C和N的积累。20-60cm土层中FLF-C、IPOM-C和IPOM-N的库存量以及20-40cm土层中FLF-N的库存量在顶极林中最高(图2),这可能仍然受到最大凋落物输入的影响(图S1a)。MAOM-C(20-60 cm)和MAOM-N(40-60cm)的储量不受自然植被恢复的影响(图2),这主要归因于根系生物量,以及微生物生物量。这些是较深层土壤中MAOM变化不受植被恢复影响的重要驱动因素(表S2)。
自然植被的恢复极大地改变了SOM组分中C和N的分布和稳定性(图5)。FLF被广泛认为是最新鲜、最不稳定的组分,分解速度快,不受土壤的物理或化学保护,可被微生物获取。相反,MAOM是最古老和最持久的成分,生物利用度和分解率较低,在土壤中停留时间较长,因为它与矿物质发生化学结合。然而,由于IPOM受到土壤团聚体的物理保护,它的停留时间比FLF更长。在本研究中,随着自然植被的恢复,表层土壤中FLF中C(即FLF-C/SOM-C)和IPOM中N(即IPOM-N/SOM-N)的分布比例(0-60cm)、IPOM中C(即IPOM-C/SOM-C)和FLF中N(即FLF-N/SOM-N)的分布比例逐渐增大(图5)。这表明,自然植被恢复通过增加非保护和纯物理保护的C和N的分布比例,降低化学保护的C和N的分布比例,改变了土壤表层土壤C和N的稳定性(图5)。一般来说,在SOM分解过程中,C:N比值会降低,C:N比值越高意味着SOM分解速率越低。在本研究中,表层土壤SOM的C:N比值随着自然植被的恢复而逐渐增强,这主要是由于FLF和IPOM中C:N比值的增加(图3)。顶极林表层土壤中FLF和IPOM分解较低(图3)可能主要归因于顶极林中抗分解的凋落物C:N比率较高(图S1)。
自然植被恢复显著(P<0.001)改变了SOM组分之间的δ13C和δ15N稳定同位素特征(表1),并影响了C和N的转换(表3)。在本研究中,与其他植被恢复阶段(表3)相比,SOM、FLF和IPOM(0-60cm)的δ13C值在农田中最为丰富,这可能是因为FLF和IPOM的δ13C值与现有的直立植被相似。我们发现,对于每个植被阶段的每个土壤深度,δ13C值随着SOM分解从FLF到IPOM再到MAOM逐渐增加(表3)。微生物处理可能导致土壤C中13C的富集,因为细菌更喜欢代谢富含12C的化合物,最终导致更多的12C通过土壤呼吸流失,而13C则在SOM分解过程中保留。据报道,微生物在SOM分解过程中更喜欢使用14N,因此土壤中δ15N的富集,在每个植被阶段的每个土壤深度,从FLF、IPOM和MAOM向环境大气损失更多的14N。此外,SOM、FLF、IPOM和MAOM中δ13C和δ15N值在深层土壤(20-60cm)中比表层土壤(0-20cm)中更富,很少有例外。有人认为这是由于MAOM(20-60cm)中C和N的分布比例增强所致,这意味着更深的土壤中SOM分解增加(图5c和f)。这导致了在微生物处理下12C和14N的损失,δ13C和δ15N的富集。
160年的自然植被恢复显著促进了土壤表层C和N的固存,主要是通过FLF和IPOM中C和N的积累,以及植被恢复后期表层土壤中MAOM中C和N含量的缓慢增加。
表层土壤随自然植被的恢复,C和N在FLF和IPOM中的分布比例增加,而在MAOM中的分布比例降低。δ13C和δ15N值随有机质分解和土壤深度的增加而逐渐增加。土壤有机质δ15N值越高,土壤有机质C:N比值越低,说明土壤氮循环越容易发生氮流失,且土壤有机质分解程度越高。
结果表明,自然植被通过增强表层土壤有机质及其组分中C和N的固存作用,对表层土壤有机质中C和N的稳定起着至关重要的作用,并通过增加非保护和纯物理保护的C和N的相对分布,减少化学保护的C和N的相对分布,极大地改变了表层土壤有机质中C和N的稳定。
氨基糖、木质素、PLFA
磷组分、有机酸、有机氮组分
微生物量碳氮磷、同位素等
其他土壤、植物、水体等常规检测指标均可测定,欢迎咨询相关工作人员了解详情
服务热线:028-85253068
18682730999(微信同号)
公司地址:成都市成华区四川检验检测创新科技园2号楼4层
