原名:Global patterns in mycorrhizal mediation of soil carbon storage, stability, and nitrogen demand: A meta-analysis
译名:菌根介导土壤碳储量、稳定性和氮需求的全球模式:一项荟萃分析
期刊:Soil Biology and Biochemistry
IF:8.546
发表时间:2022-03
第一作者:Yuntao Wu
了解控制土壤有机质(SOM)储量及其稳定性的因素对预测土壤有机质对环境变化的响应具有重要意义。菌根真菌在调节土壤碳(C)和氮(N)循环中的作用日益被人们所认识。然而,菌根真菌如何影响不同土壤组分的C分布和N需求还不清楚。在这里,我们收集了来自丛枝菌根(AM)和外生菌根(ECM)主导生态系统的不同SOM组分的C和N浓度的全球数据集,涵盖了主要的生物群落,包括热带森林、温带森林、针叶林和草地。在此基础上,研究了菌根共生对不同稳定性SOM组分碳储量和碳氮化学计量的影响。研究发现,无论是表层土还是深层土,ECM生态系统的非根际土壤C储量和C:N比值均高于AM生态系统,颗粒有机质含量(POM)也有相似的变化规律。而在AM和ECM生态系统中,矿物相关有机质(MAOM)中的碳储量没有差异。此外,随着非根际土壤C浓度的增加,表层土壤MAOM碳储量在ECM生态系统中趋于稳定,而在AM生态系统中则持续增加。随着土壤N浓度的增加,ECM生态系统非根际土壤C储量的增长速度高于AM生态系统,这主要是受POMC储量增加的驱动。我们的研究强调了AM和ECM生态系统土壤C储量和相对稳定性的差异。尽管ECM生态系统的土壤C储量较高,单位土壤C的N需求量较低,但大部分C分布在相对不稳定的POM中。因此,ECM生态系统的SOM可能更容易受到土地利用和气候变化引起的干扰。
几乎所有的植物根都与菌根真菌共生。丛枝菌根(AM)至少起源于4.6亿年前,在80%的维管植物科中都有发现。外生菌根真菌(ECM)比AM真菌的进化晚了大约3亿年。虽然只有约2%的植物物种与ECM相关,但地球上约60%的树茎是ECM的共生体。AM和ECM植物具有不同的养分经济和凋落物质量;因此,它们对土壤有机质(SOM)积累的贡献可能不同。事实上,近几十年来,菌根真菌在调节土壤碳(C)和氮(N)动态方面的重要作用已得到越来越多的认识。多项研究表明,ECM植物主导的生态系统比AM植物主导的生态系统每单位氮储存更多的土壤C。然而,这些研究大多集中在表层土壤C的大量储存。SOM是具有不同稳定性的非均质组分的复杂混合物。菌根共生对土壤有机质C、N含量的影响随土壤深度和不同稳定性土壤组分的不同而不同。然而,全球的模式和潜在的机制还没有被完全理解。
SOM是最大的陆地C碳池。因此,控制SOM储存和稳定性的因素在很大程度上调节了大气CO2。有机质可分为颗粒有机质(POM)和矿物伴生有机质(MAOM)。两种SOM形式的形成和稳定性不同于其他形式。POM主要由未完全分解的凋落物残基组成,而MAOM主要由微生物残基、植物源性化合物和螯合化合物在土壤矿物表面的吸收形成。总的来说,MAOM比POM更稳定,因为受矿物保护的C很难被土壤微生物分解。然而,土壤团聚体中的POM(oPOM),其化学性质与游离POM相似,由于与分解者在物理上断开,所以可以与MAOM一样稳定。
与AM和ECM真菌共生的植物具有不同的营养经济,这可能会对不同SOM组分中的C循环和N保留产生不同的影响。AM真菌缺乏从复杂有机物中释放营养物质的酶。然而,AM真菌将共生植物的光合产物传输给腐生微生物,后者将SOM矿化并释放无机N作为交换。不同于AM真菌与腐生微生物之间一般互惠互利的关系,ECM真菌与腐生微生物之间通常存在竞争关系。ECM真菌可以产生胞外酶(如水解酶和蛋白酶),从而与腐生生物竞争有机氮。此外,AM叶和根系凋落物相对于ECM而言,有较高的N浓度和较低的C:N比。因为在利用高质量的AM凋落物时,微生物可以更有效地产生代谢物和残留物,因此可以合理地预计AM生态系统中的微生物残留物产量可能高于ECM生态系统。由于微生物残留物是稳定形成MAOM的主要来源,AM主导的生态系统应该具有更高的MAOM含量,在ECM生态系统中更容易形成POM。此外,ECM真菌已被证明比AM真菌产生更多的外部菌丝。众所周知,菌根菌丝促进土壤团聚体的形成,因此在ECM生态系统中,存在于微团聚体中的POM可能高于AM生态系统。
由于菌根真菌的生物量和根系定殖水平往往随着土壤深度的增加而下降,菌根共生对深层土壤C和N循环的影响可能与对表土的影响不同。事实上,Craig(2018)等人最近的一项研究发现,ECM主导的森林在表土中积累了更多的SOC,这与几项跨生物群系研究一致。然而,在考虑到1米深的深层土C库后,他们发现AM主导的森林储存了更多的C。这可能是由于AM植物的根和菌丝通常比ECM植物的根和菌丝具有更高的N浓度和更快的周转率。因此,AM植物的根源性C在深层土壤中积累量较高。此外,与顽固的ECM凋落物在分解过程中产生的粗有机颗粒相比,优质AM凋落物在分解过程中产生的溶解有机质更容易渗透到下层土壤中。然而,Craig等人(2018)在当地研究中观察到的垂直模式是否也适用于更大的生态区域,这在很大程度上是未知的。
虽然菌根真菌可以改变土壤C组分的组成,但这种影响几乎没有定量评估。气候条件、土壤深度、土壤质地和地球化学性质对土壤C的储存和稳定性有很大影响。因此,菌根真菌对不同SOM组分的影响可能因气候和土壤条件而异。在此,我们编制了一个涵盖主要生物群落的全球数据集,并评估了菌根真菌对不同SOM组分中C和N含量的影响。我们假设,由于ECM植物凋落物质量较低,且ECM真菌和腐生微生物之间的竞争关系较强,ECM生态系统可能比AM生态系统具有更高的POM含量、土壤C储量和更低的单位土壤C中N需求量。此外,由于表层土壤具有较高的菌根真菌生物量,菌根共生对表层土壤C储量和稳定性的影响大于深层土壤。
1.生物和环境因素对SOM组分的影响
综合所有研究,表层土壤POM的C含量(POM-C)随MAT、MAP和地上植物生物量的增加而增加,随采样深度和粘土浓度的增加而降低;表层土壤中MAOM的C含量(MAOM-C)随MBC的增加而增加(图1)。表层土壤POM-C含量与生物和环境因子无关,而表层土壤MAOM-C含量随MAT和MAP的增加而降低。线性混合效应模型表明,表层土和深层土POC-C和MAOM-C均与非根际土C含量呈正相关(图2)。菌根共生对表层土POM-C和MOAM-C含量有显著影响(表1)。除土壤C含量和菌根共生关系外,表层土壤MAOM-C显著受粘土浓度、地上生物量和土壤分离方法的影响(表1)。MAT对POM-C有正向影响,对深层土壤MOAM-C有略微的负面影响(表1)。
2.在AM和ECM主导的生态系统中不同SOM组分的C和N含量
无论是表土还是深层土,ECM生态系统的非根际土中C储量和POMC含量均显著高于AM生态系统,而MOAMC含量在AM和ECM生态系统之间无显著差异(图3a,d)。此外,AM和ECM生态系统表层和深层土中非根际土和MOAM的N含量没有差异(图3b,e)。ECM生态系统中POM和oPOM的表土N含量显著高于AM生态系统(图3b)。无论是表土还是深层土,ECM生态系统中非根际土、POM和MAOM的C:N比均高于AM生态系统(图3c,f)。
基于贝叶斯混合效应模型,考虑了MAT、MAP、粘土浓度、土壤取样深度和土壤分选方法的影响,结果与威尔科克森秩和检验基本一致(图4)。然而,贝叶斯方法表明,ECM生态系统的表层土壤氮含量较高(图4b),但在AM和ECM主导的生态系统之间,表层和深层土的MAOMC:N比值没有差异(图4c,f)。对于深层土,AM和ECM生态系统的非根际土C含量无差异,但ECM生态系统的POMN含量高于AM生态系统(图4d,e)。
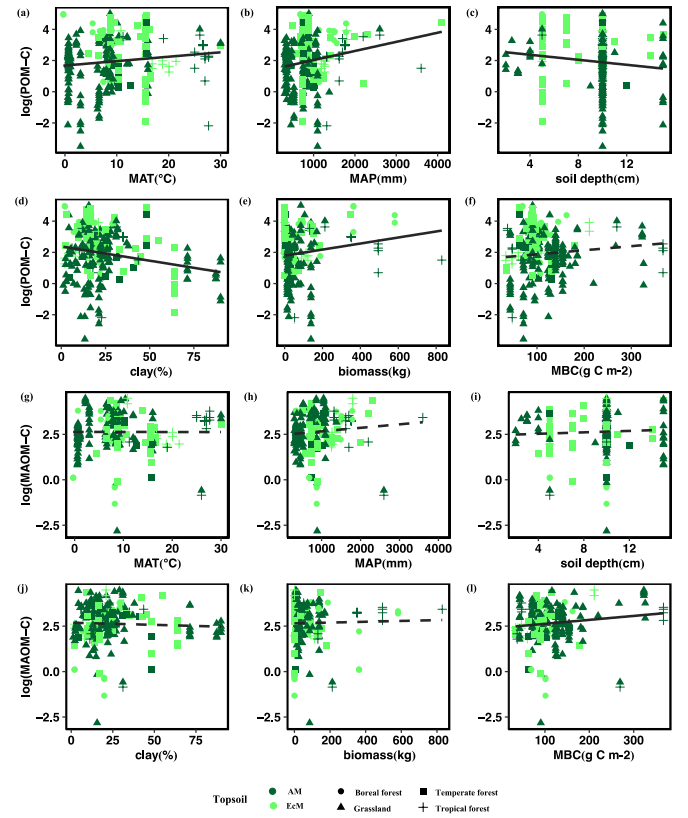
图1原木转移表土POMC含量(a-f)和表土MOAMC含量(g-l)与MAT、MAP、土壤深度、
表土粘粒浓度、地上植物总生物量(生物量)和表土微生物生物量碳(MBC)的关系
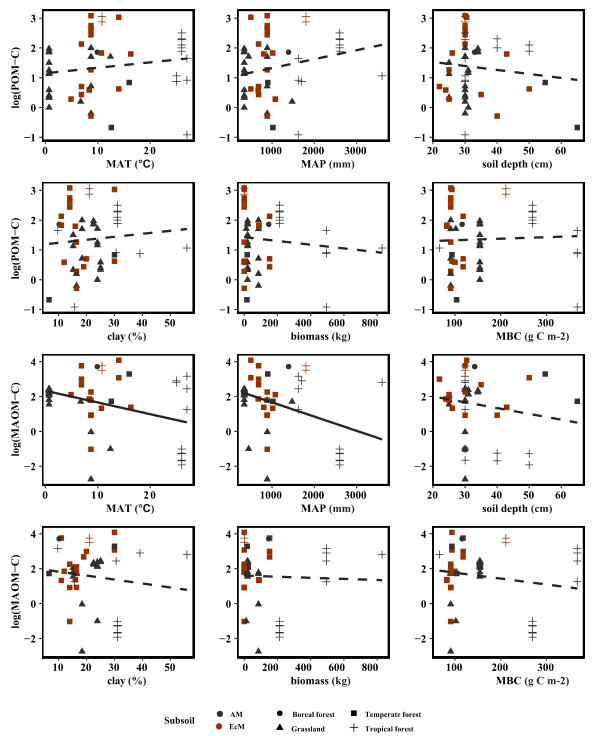
图2原木转移深层土POMC含量(a-f)和深层土MOAMC含量(g-l)与MAT、MAP、
土壤深度、表土粘粒浓度、地上总生物量和表土微生物生物量碳(MBC)的关系
表1表层和底土POM和MAOMC含量线性混合效应模型的结果
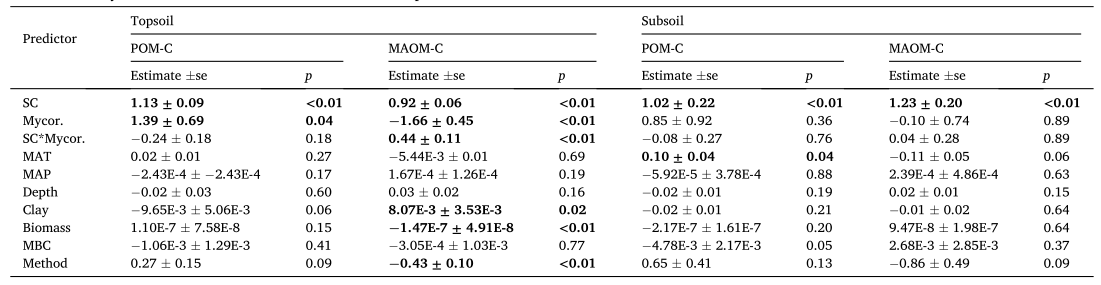
图3AM和ECM生态系统中非根际土、POM和MAOM的表土和深层土
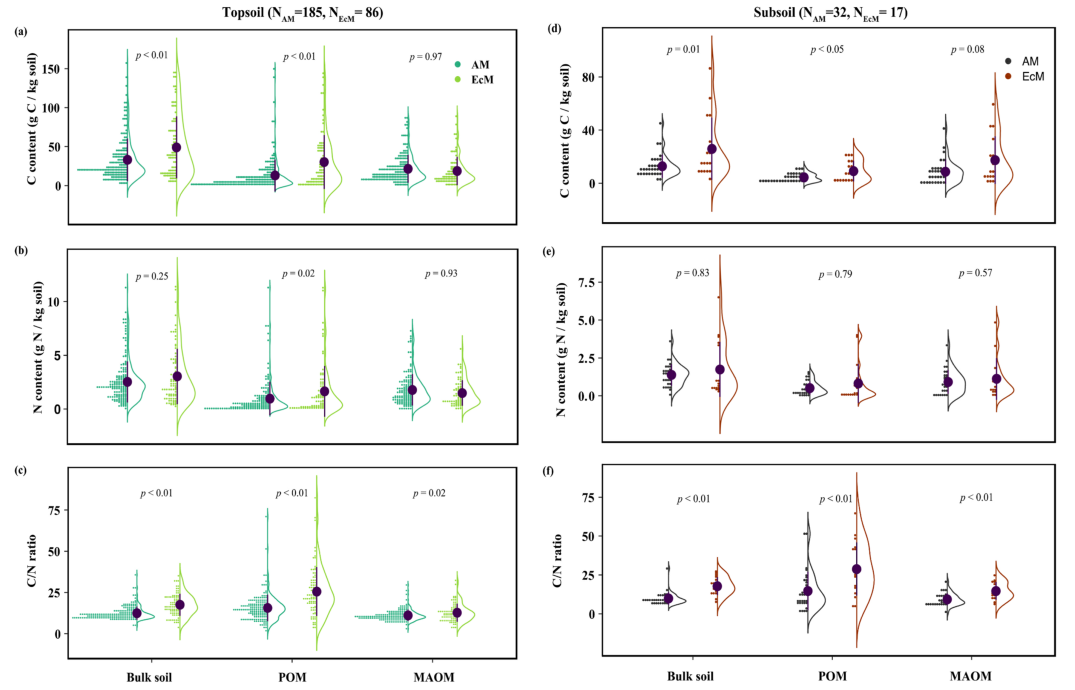
C(a, d)、N(b, e)和C:N比值(C,f)点小提琴图
图4利用贝叶斯混合效应模型估算AM和ECM主导生态系统
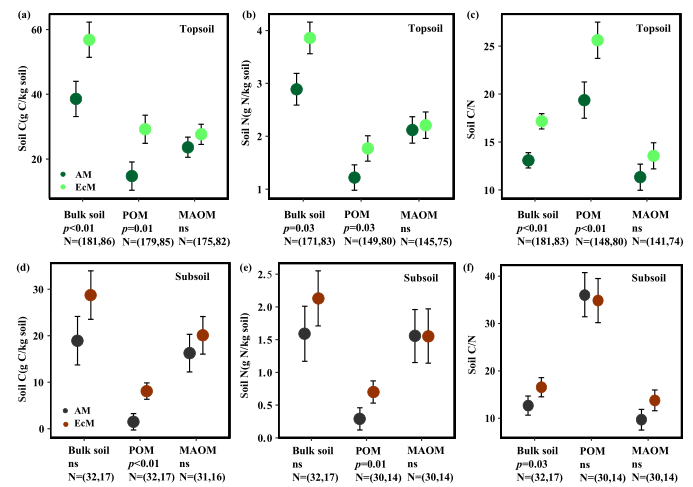
表土和深层土C(a,d)、N(b,e)和C:N比值(C,f)的均值。
3. 随着非根际土壤C的增加,不同SOM组分中C的分布
与AM生态系统相比,ECM生态系统的表层土壤POM-C增长更快,但表层土壤MAOM-C随着非根际土壤C的增加增长更慢(图5a,b)。在深层土壤中也观察到类似的模式(图5c,d)。此外,随着非根际土壤C储量的增加,当非根际土壤C含量大于95gC/kg土壤时,ECM生态系统的表土MAOM-C达到明显饱和,而AM生态系统的表土MAOM-C继续增加(图5b)。此外,AM和ECM生态系统的表土oPOM-C均随土壤C体积含量线性增加,且ECM主导生态系统的截距高于AM主导生态系统。
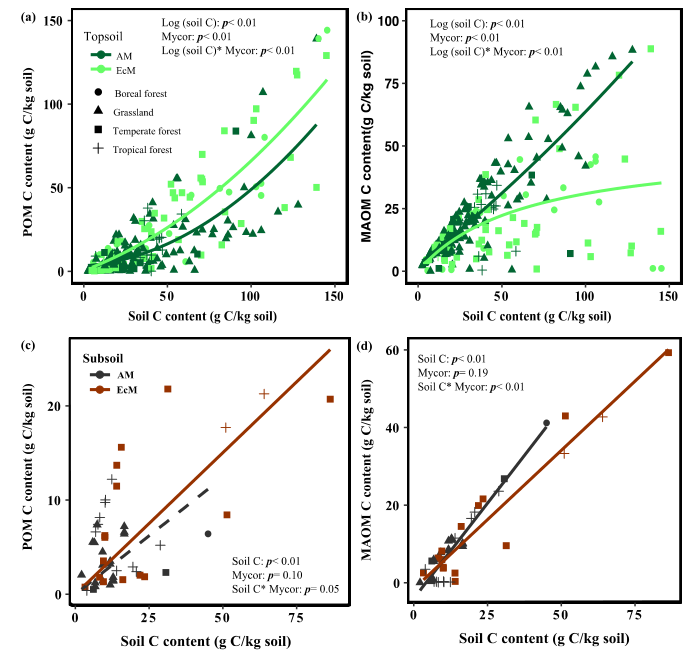
图5AM和ECM主导生态系统表土和深层土POM(a、c)和
MOAMC含量(b、d)随非根际土壤C含量的增加而变化
4. 不同SOM组分对SOC存储的N需求
随着土壤N含量的增加,ECM生态系统的表土土壤C储量比AM生态系统增加得更快(图6a),表土POM-C也观察到类似的趋势(图6b)。然而,随着土壤N含量的增加,AM生态系统表土MAOM-C的增加速度比ECM生态系统快(图6c)。与表土不同的是,随着土壤N含量的增加,非根际、POM和MAOM的深层土壤C储量在AM和ECM生态系统中表现出类似的模式(图6d,e, f)。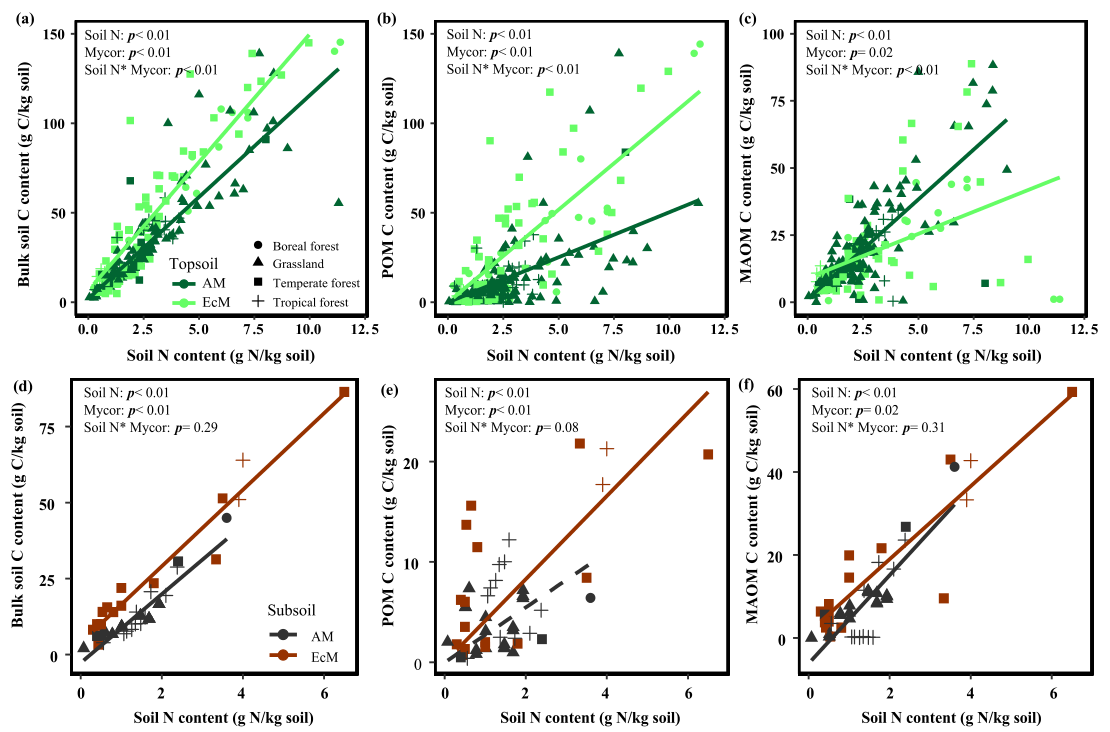
图6AM和ECM主导生态系统表土和深层土C含量(a、d)、POMC含量(b、e)和
MOAMC含量(c、f)随非根际土壤中N含量增加的变化规律
5.AM和ECM主导的生态系统中SOC存储的局限
在AM主导生态系统中,AM植物生物量与MAT呈显著正相关。AM生态系统表土MAOM-C受MBC正向调节,与AM植物生物量呈正相关(图7a)。表层土壤MAOM-C受AM植物生物量的正向调节,与表层土壤粘粒浓度呈负相关(图7c)。在AM主导的生态系统中,无论是表土还是深层土,非根际碳储量受MAOM-C的影响都大于POM-C(图7a,C)。
在ECM主导的生态系统中,ECM植物的生物量与MAT、粘土和淤泥浓度呈负相关(图7b)。在以ECM为主的生态系统中,表层土壤POM-C与ECM植物生物量呈正相关,而表层土壤MAOM-C与MBC、粘土和粉砂浓度呈正相关(图7b)。对于ECM主导的生态系统,表层土壤中非根际土C的储量受POM-C的影响大于MAOM-C的影响(图7b,d),而下层土壤中非根际土C的储量受MAOM-C的影响大于POM-C的影响(图7d)。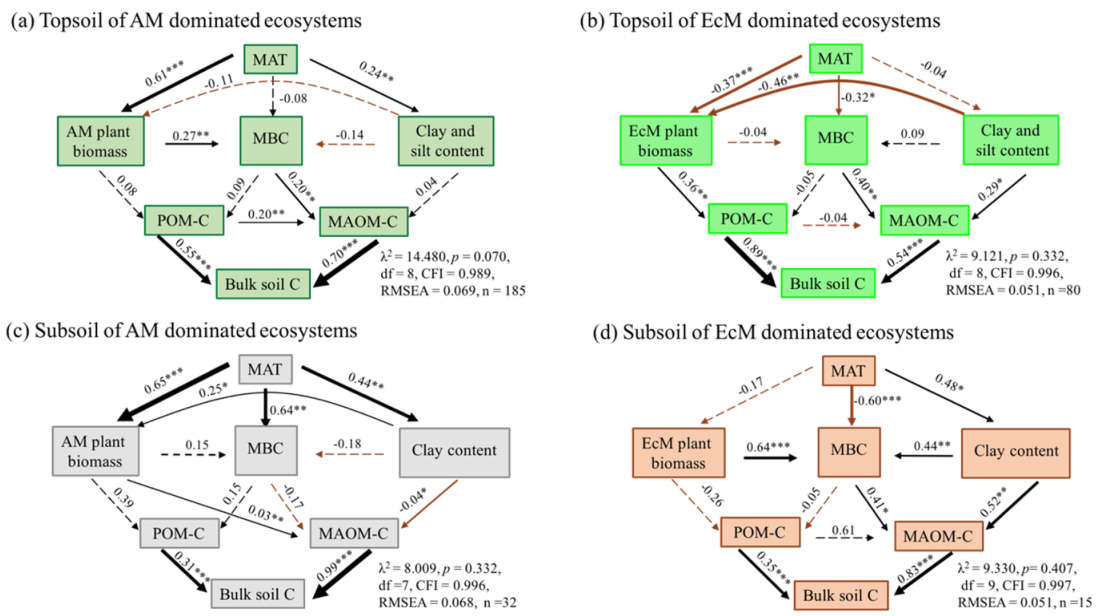
图7AM (a, C)和ECM主导生态系统(b,d)中多种驱动因素对
表土和深层土碳储量影响的结构方程模型(SEM)分析
本研究表明,菌根功能性状在调控土壤C的储存以及SOM在不稳定组分(POM)和稳定组分(MAOM)中的相对分布中起着至关重要的作用。
结果表明,ECM生态系统的非根际土壤在表土和深层土中都显著高于AM生态系统。这是因为ECM生态系统中的非根际土壤C含有更多的POM-C,这需要较少的N,可以在不饱和的情况下积累。相反,AM生态系统中大部分土壤C储存在MAOM-C中,需要更多的N,可以饱和。气候变化和土地利用变化不仅会改变AM和ECM物种的分布,而且菌根真菌和自由生活微生物分解者之间的相互作用影响土壤C在不同稳定性组分中的储存和分布。
本研究定量比较了AM和ECM生态系统的碳储量、稳定性及其N需求,有助于更好地理解全球变化下土壤碳动态的潜在响应。
论文id:https://doi.org/10.1016/J.SOILBIO.2022.108578
氨基糖、木质素、PLFA
磷组分、有机酸、有机氮组分
微生物量碳氮磷、同位素等
其他土壤、植物、水体等常规检测指标均可测定,欢迎咨询相关工作人员了解详情
服务热线:028-85253068
18682730999(微信同号)
公司地址:成都市成华区四川检验检测创新科技园2号楼4层
