基本信息:
原名:Plant-derived lipids play a crucial role in forest soil carbon accumulation
译名:植物源脂类在森林土壤碳积累中发挥至关重要的作用
期刊:Soil Biology and Biochemistry
2020年影响因子: 7.609
在线发表时间:2022.3.24
第一作者:Guohua Dai
通讯作者:Xiaojuan Feng
第一单位:中国科学院植物研究所植被与环境变化国家重点实验室
研究背景
植物和微生物残体是土壤有机碳的两种主要来源。虽然最近的研究广泛地监测了微生物残体在不同生态系统中的分布,但植物残体(特别是非木质素成分)对有机碳积累的贡献尚不清楚,特别是在占全球土壤碳储量50%的森林中。填补这一知识空白将有助于我们更好地理解SOC积累模式及其对土地利用变化的响应。
研究方案
本研究采集了从南部阔叶林到北部针叶林范围内的中国17个主要的森林类型的0-10cm的矿质上层土壤(Fig.1),分析了中国森林土壤中植物和微生物来源的脂类生物标志物(游离脂类和可水解脂类),并将其在有机碳中的分布与木质素酚类物质进行了比较,并进一步与全球分布森林和草地土壤中木质素酚类和氨基糖类的分布特征进行了比较。综合评价了森林类型和环境因素对植物和微生物残体在驱动有机碳积累中的相对重要性。提出两个假设:(1)与草地相比,植物源成分在森林有机碳积累中的作用更大; (2)与木质素相比,植物源脂类对森林有机碳积累的贡献更大,因为植物脂类对土壤矿物质具有较高的亲和性。
主要研究结果
在全球尺度上,森林土壤微生物残体含量显著低于草地,表明植物源组分对森林土壤有机碳的贡献较大。然而,木质素酚类物质与土壤有机碳含量呈负相关关系,在土壤有机碳积累过程中并没有发挥重要作用。相反,在调查的中国森林中,叶源和根源的可水解脂类所占的土壤有机碳比例远高于木质素酚,甚至高于草地土壤。此外,与木质素酚相比,森林土壤有机碳含量和可水解植物脂质相对丰度均随土壤pH的降低、活性铁和铝含量的增加以及木质素氧化(以酸醛比表示)的增加而增加。这些结果表明,随着木质素分解的增加,植物脂质和有机碳通过氧化保护积累。
Fig. 1 Location of 17 sampling sites (a) of Chinese forests underlain by China’s vegetation map (1:1000000) and global distribution of soil lignin phenol and amino sugar measurements included in this study (b). A total of 355 and 467 data points were obtained from data reported in 47 and 51 peer-reviewed journal articles published before December 2021 for lignin phenols and amino sugars, respectively. WY: Wuying; CB: Changbai Mountain; DL: Donglingshan; TB, Taibaishan; JG: Jigongshan; GG, Gonggashan; GNJ, Guniujiang; BD, Badagongshan; HSD, Heishanding; JFL, Jianfengling.
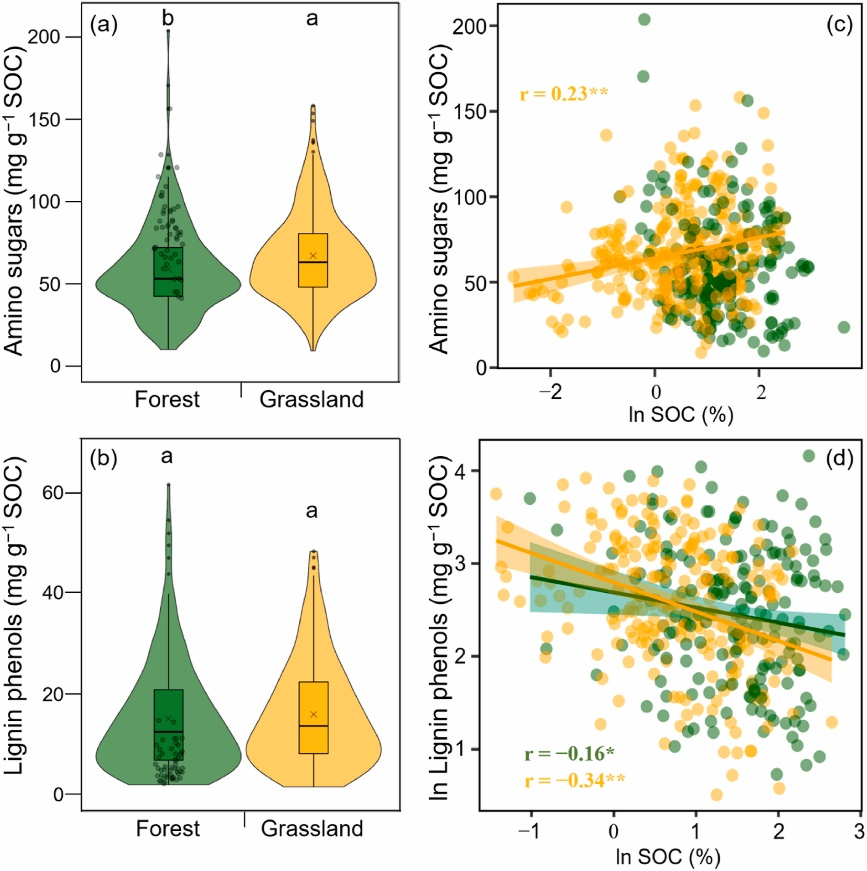
Fig. 2 Soil organic carbon (SOC)-normalized contents of amino sugars (a) and lignin phenols (b), and their relationships with SOC contents (c–d) in the forest and grassland soils. The amino sugar and lignin phenol contents are compiled from the literature (details in Supplementary dataset Tables S2–S3) and our own data from Chinese forests (Fig. 1a). Shapes of the violin represent the distribution pattern of the corresponding data. The upper and lower ends of boxes denote the 0.25 and 0.75 percentiles, respectively. The solid line and cross in the box mark the median and mean of each dataset, respectively. Solid dots denote outliers. Hollow dots denote our own data. Letters indicate significant differences between forests and grasslands (p < 0.05). Green and yellow lines represent correlation (p < 0.05) across forest and grassland soils, respectively. Shaded areas represent the 95% confidence intervals for the regression lines. * and ** indicate significant correlation at the level of p < 0.05 and p < 0.01, respectively.
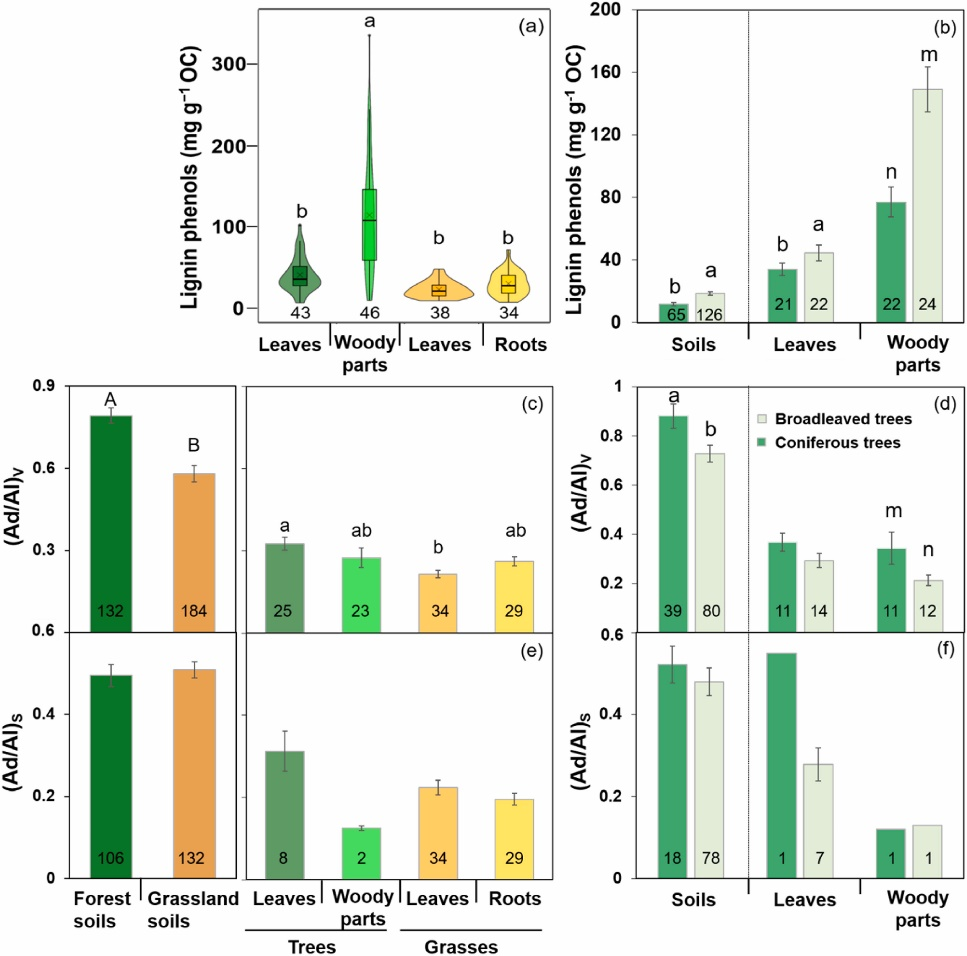
Fig. 3 Organic carbon (OC)-normalized contents of lignin phenols in plant tissues (a), broadleaved and coniferous trees and corresponding soils (b), the acid-toaldehyde (Ad/Al) ratios of vanillyl (V; c-d) and syringyl (S; e-f) phenols in forest and grassland soils and plant tissues. Symbols of the box and violin charts are defined in Fig. 2. Numbers represent the number of data. Different upper- and lowercase letters indicate significant differences between forests and grasslands and among different plant tissues (note: a and b for leaves, and m and n for woody parts), respectively (p < 0.05). All data for plant tissues are compiled from the literature.
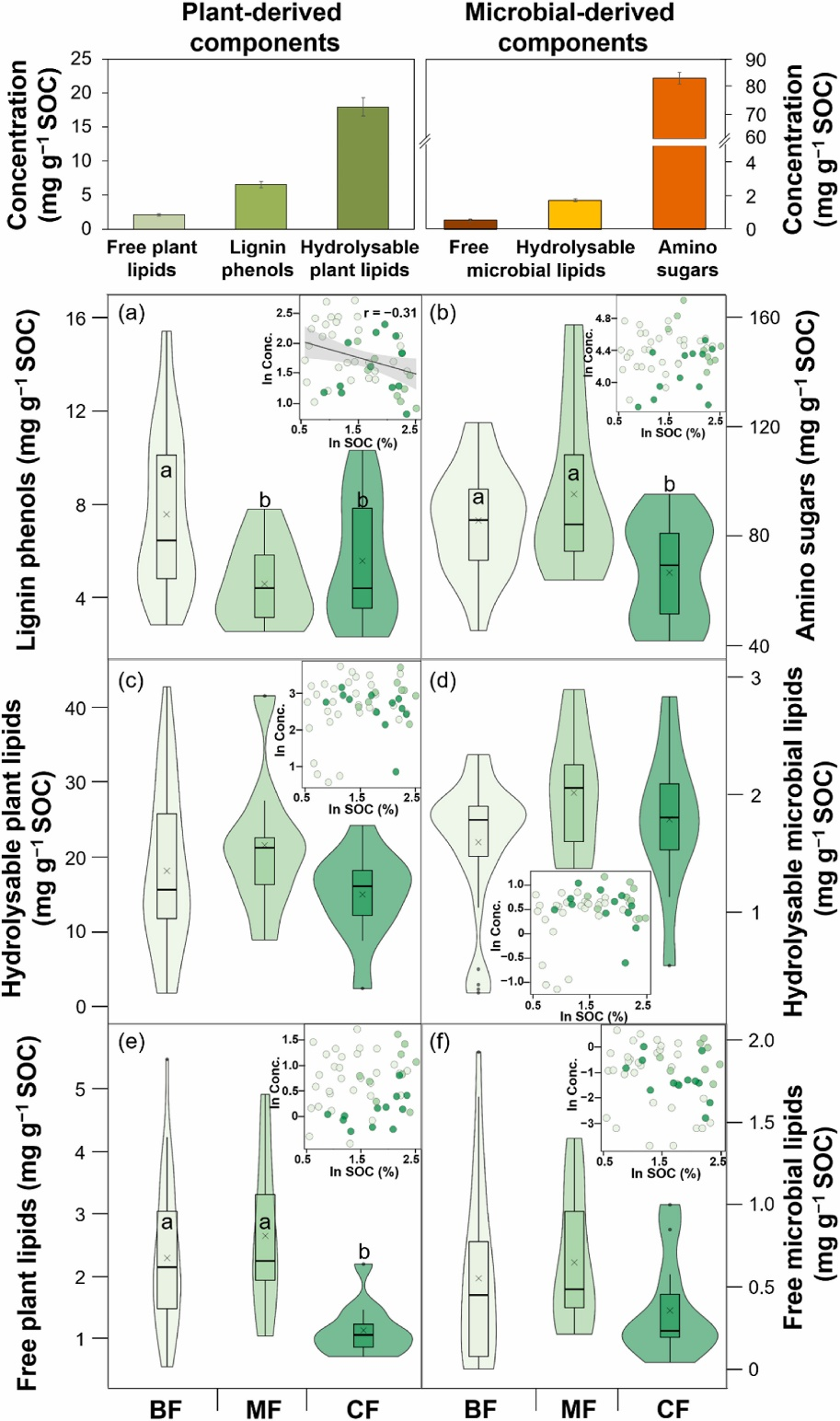
Fig. 4 Soil organic carbon (SOC)-normalized contents of lignin phenols (a), amino sugars (b), hydrolysable plant lipids (c), hydrolysable microbial lipids (d), free plant lipids (e) and free microbial lipids (f) in the Chinese forest soils. BF, broadleaved forest (site = 10); MF, broadleaved and coniferous mixed forest (site = 3); CF, coniferous forest (site = 4). Symbols of the box and violin charts are defined in Fig. 2. Letters indicate significant differences among three forest types (p < 0.05). The bar charts give the relative abundance of plant- and microbial-derived components. The inserted graphs give the relationships of different components with SOC contents. Black line represents correlation (p < 0.05) across three forest types. Shaded area represents the 95% confidence interval for the regression line.
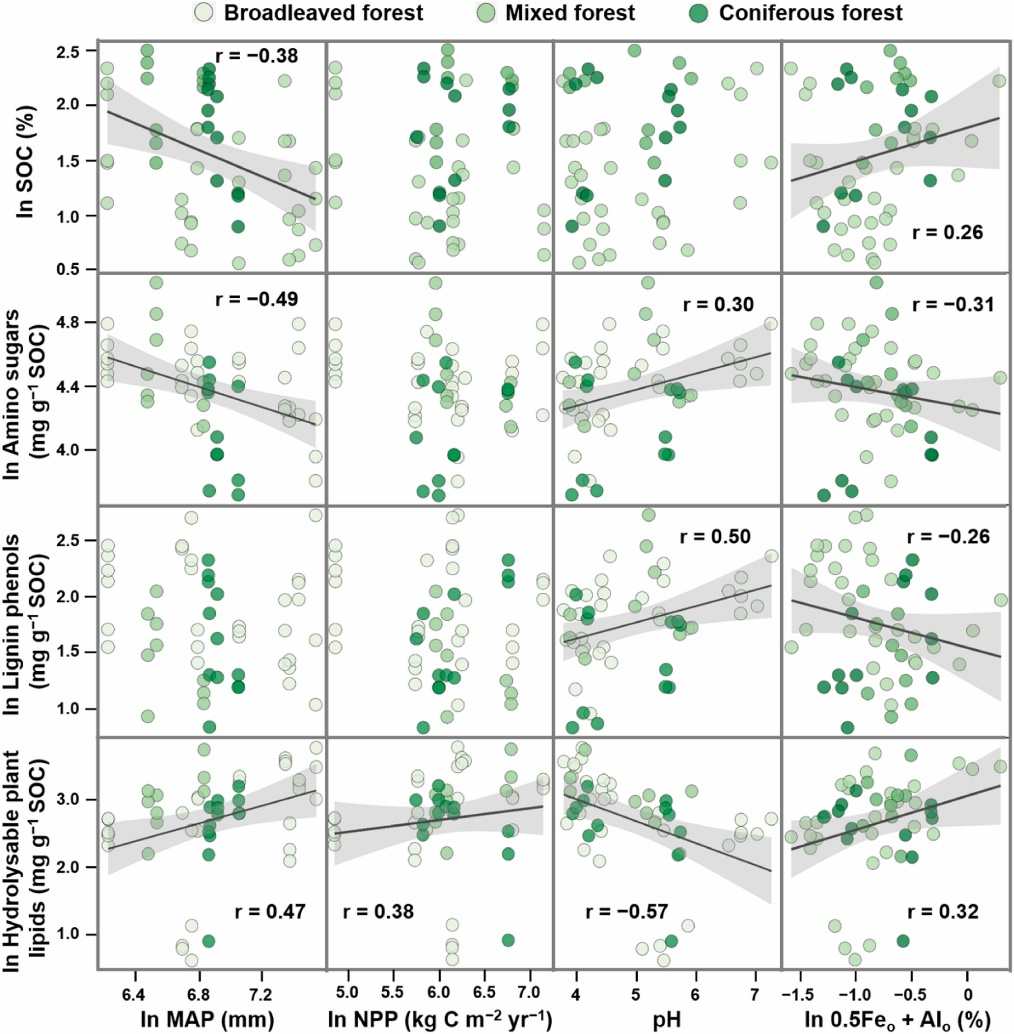
Fig. 5 Relationships of soil organic carbon (SOC) and the SOC-normalized contents of amino sugars, lignin phenols and hydrolysable plant lipids with the environmental variables in the forest soils of China. Black lines represent correlation (p < 0.05) across three forest types. Shaded areas represent the 95% confidence intervals for the regression lines.
Fig. 6 Relative importance of different environmental variables for the contents of SOC, amino sugars, lignin phenols and hydrolysable plant lipids in the Chinese forest soils. * indicates significant independent effects (p < 0.05). The plus (+) and minus in the parentheses represent positive and negative effects, respectively (p < 0.05).
Fig. 7 Relationships of soil organic carbon (SOC) and the SOC-normalized contents of lignin phenols and hydrolysable plant lipids with the acid-to-aldehyde (Ad/Al) ratios of vanillyl (V) and syringyl (S) phenols in the forest soils of China. Black lines represent correlation (p < 0.05) across three forest types. Shaded areas represent the 95% confidence intervals for the regression lines.
结论
研究表明,植物源性成分在森林和草地有机碳积累中的重要性不同,并强调植物源脂类可能比木质素在森林有机碳积累中发挥更重要的作用。以往的研究主要关注木质素对土壤有机碳的贡献,未来的研究应更多地关注植物源脂类,尤其是森林土壤。通过定量研究角质和软木脂在土壤中的分布和留存,可以揭示木质素分析无法识别的植物成分主导的土壤有机碳积累的途径和热点。