1.分解和微生物分解者
在为期3年的实验中,土壤化学和生物性质(图1)受时间和网袋尺寸的显著影响。1000µm处理生长袋中各年土壤有机质和总氮损失量最高(图2a,b)。在第三年,真菌菌丝处理(50µm)也有加速SOM和N损失的趋势(图2a,b)。
这些结果证实了第一个假设,即与缺乏植物C输入(1µm处理)的微生物相比,植物C支持的微生物增加了SOM分解。植物根系对SOM分解率的积极影响与前人关于根际激发效应的研究一致,也与根际分解显著高于非根际土壤的meta分析一致。与同一年的其他处理相比,真菌PLFA标记在1000µm处理中随着时间的推移变得更占优势(图2c),而细菌仅在第二年在1000µm处理中表现出更高的丰度(图2d)。因此,在1000µm处理下,最高的SOM分解可能归因于真菌分解者在植物源碳输入(即根际激发)的支持下活性增加。
根据1000µm处理下较高的SOM分解速率,预计微生物活性会增强,稳定的SOM-N(化学稳定的N库)会减少,这与根际激发的N挖掘假设和假设1一致。虽然真菌丰度在1000µm处高于其他处理,但没有发现更高的土壤CO2产量或土壤酶活性。与其他处理相比,1000µm处理的土壤呼吸仅略高,酶活性基本处于相同水平,2年后只有50µm处理的活性显著高于其他处理。
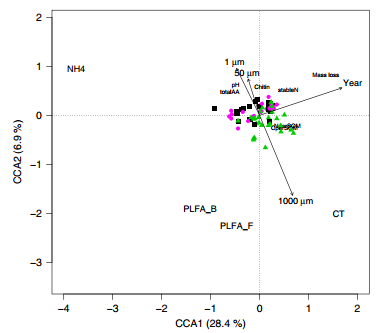
图1 处理和时间对土壤化学和生物特性的影响
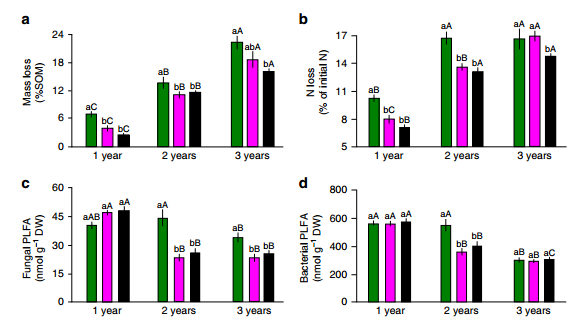
图2 土壤分解与微生物特性
2. 形成稳定的SOM
虽然SOM损失在1000µm处理中最高,但稳定的SOM-N库在三种处理中也表现出最强的增长,3年后增长了23% (图3a)。这一结果与假设1相矛盾,表明植物根系的存在不仅促进了SOM的净分解,同时也促进了稳定SOM-N的形成。用傅里叶变换红外光谱(FTIR)对网袋土壤进行表征,发现不同处理之间主要存在多酚和多肽的差异。在1000µm处理下,浓缩单宁(CTs)浓度和代表多酚的FTIR吸光度值最大(图3b, c),且CTs与稳定的SOM-N显著相关(图3d)。
此外,代表多肽的FTIR吸光度值以及甲壳素的浓度在1000µm的处理中也是最大的(图3e,f)并与CTs相关。在此提出,稳定的SOM-N的显著增加是由于与根源性CT形成络合物,即能够与蛋白形成络合物的多酚,以及其他有机N化合物,如几丁质。这些结果与之前的论文结果一致,在论文中表明CT稳定了北方森林土壤中的真菌残体。因此,认为有机N-CT复合物的形成是植物根存在时SOM-N稳定的机制之一,这与根和真菌来源的生物量中SOM的积累一致并支持假设2。
在实验中,稳定的SOM-N的形成在3年后达到5mg N/g SOM。假设蛋白质和几丁质与CT的络合作用是稳定的SOM-N形成的原因,并且知道复合物的C:N比约为6:137,可以将其推断为3年后稳定的30mg C。考虑到细根周转量可能高于先前的假设,并且细根向土壤提供了大量的碳水化合物,这一机制可能在北方森林土壤的SOM稳定中发挥重要作用。此外,真菌生物量的增加可以通过氮固定化直接降低氮的有效性,并通过产生顽固性黑色素来增加SOM的稳定性。因此,这些潜在的SOM积累机制可以解释外生菌根树木如何降低北方森林生态系统的氮有效性并推动土壤C积累。
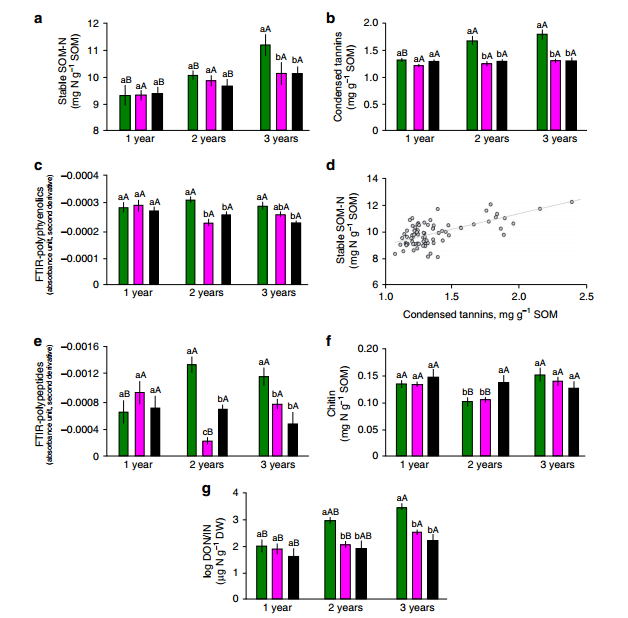
图3 土壤化学及其与浓缩单宁的相关性
此外,在N循环中考虑通过与CT反应形成稳定的SOM-N的作用是很重要的。单宁对蛋白质的络合作用已被提出诱导氮素循环由无机为主向有机为主转变,即从凋落物中释放出来的溶解氮越来越多是以有机形式而不是矿物质形式存在的。根据这一概念,观察到溶解有机N (DON)/无机N (In)比在1000µm处理时最高(图3g),反映了天然林条件。在这种处理下,较低的无机氮素浓度可能不仅来自于较低的氮矿化,而且来自于植物根系对较高的无机氮素的吸收。之前在Hyytiälä研究地点的工作也证明了一个紧密的N循环,以有机N为主,并提出大部分被树木生物量吸收的N来自SOM分解,土壤中的无机氮可以忽略不计。
3. 土壤氮经济
综合结果表明,植物根系与相关微生物(1000µm)促进了有机土壤N经济,即有机N形态的主导和稳定的SOM-N积累(图4)。相比之下,排除根系长入(50µm)和根系以及真菌菌丝(1µm)的人工处理显示出无机土壤N经济与IN积累(图4),可能通过淋溶和反硝化促进N损失。
在北方森林中观察到的这种N经济不能简单地外推到温带和热带森林,因为温带和热带森林的土壤N储量(kgNm- 2)比北方森林低约三倍。土壤组分的数量和质量对稳定的SOM-N的形成有显著影响。例如,北方森林土壤的粘土含量几乎比温带森林低三倍,比热带森林低多达十倍。同样,菌根成分也可以发挥关键作用,因为有研究表明,在有外生菌根和根状菌根的生态系统中(如北方森林),土壤每单位氮的碳含量比以丛枝菌根植物为主的生态系统高70% ,这表明土壤碳储存的机制不同。
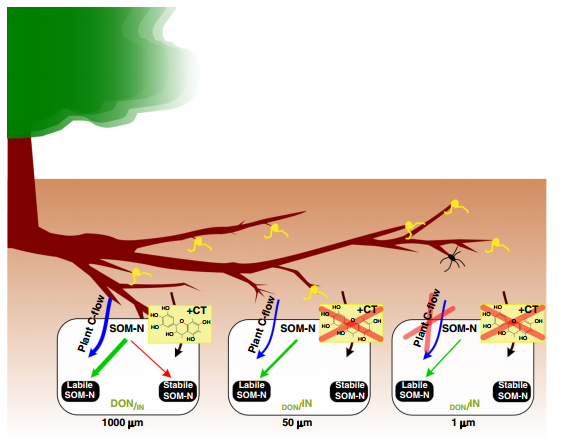
图4 SOM-N转化框架
基于网袋的实验设计可能会产生一些误差。例如,除了由于分解和吸收而从网袋中损失的SOM外,部分碳损失可能来自溶解有机碳(DOC)浸出到更深的土壤水平。有机碳向矿质土壤的迁移也可能稳定有机质,这是导致北方森林土壤百年碳库形成的原因。DOC池也可能容易从土壤中淋溶到地表水和地下水中,尽管由于未受干扰的森林土壤中DOC的流出量通常较低。与壕沟法类似,网袋操作也可能受到湿度差异和土壤动物进入限制的潜在影响。然而,在研究中,含水量和土壤动物丰度在处理之间没有显示出重大差异。总之,这些误差对研究结果没有实质性影响。