1.根系分泌物总C和组分的输入速率
干旱处理显著降低了(17.8%)四个树种根系分泌物的总C输入速率(图1a)。干旱对总C输入速率的影响与干旱对生长速率的影响显著正相关(R2= 0.66, p< .01)。对照处理和干旱处理的分泌物氮输入速率无显著差异(图1b)。
干旱处理显著降低了根系分泌物糖(30.8%)和氨基酸(35.0%)的输入速率(图1
d和e)。干旱对糖和氨基酸输入速率的影响与干旱对生长速率的影响显著正相关(R2= 0.50, p< .01;
R2 =
0.56, p< .01)。相反,干旱处理显著升高了根系分泌物有机酸(38.6%)的输入速率(图1
f)。干旱对有机酸输入速率的影响与干旱对生长速率的影响显著正相关(R2= 0.53, p< .01)。
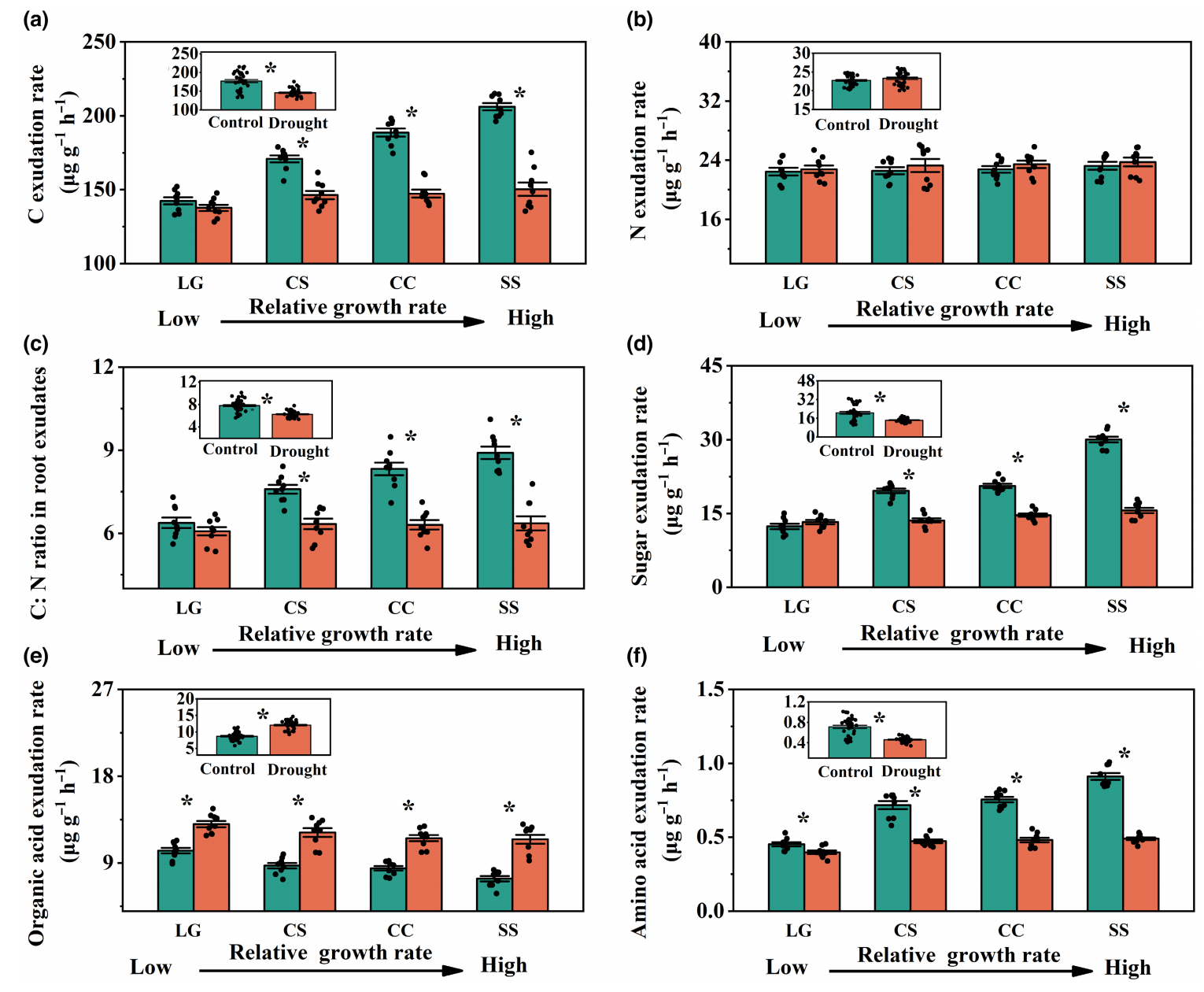
图1干旱对根系分泌物总C输入速率(a)、氮输入速率(b)、碳氮比值(c)、糖输入速率(d)、有机酸输入速率(e)、氨基酸输入速率(f)的影响。插图显示了干旱对四种树种根系渗出率的影响(n
= 36)。对照处理和干旱处理之间的显著差异用星号表示(p<
.05)。
2.根系形态特征、菌根侵染率和土壤特性
与对照相比,干旱处理显著增加了比根长(SRL:60.9%)、比根面积(SRA:26.0%)和菌根侵染率(38.8%)(图2)。生长速率较快的树种具有更大的SRL和SRA。干旱对SRL、SRA和菌根侵染率的影响与干旱对生长速率的影响显著正相关(R2= 0.51, p< .01;
R2= 0.36, p< .01;
R2 =
0.57, p< .01)。
与对照相比,干旱处理显著降低了根系直径(RD:12.1%)和组织密度(RTD:25.5%)(图2)。干旱对RD和RTD的影响与干旱对生长速率的影响显著正相关(R2= 0.50, p< .01;
R2= 0.49)。此外,在控制处理和干旱处理下,四种树种的细根生物量(FRB)均无显著差异(p= .28)。
干旱样地土壤湿度平均为15.4%(v/v),比对照区低31.9%。土壤有机碳(SOC)、TN、土壤总磷、土壤碳氮比(C/N)、土壤氮磷比(N/P)、DIN、土壤AP、土壤温度、pH均无显著差异。
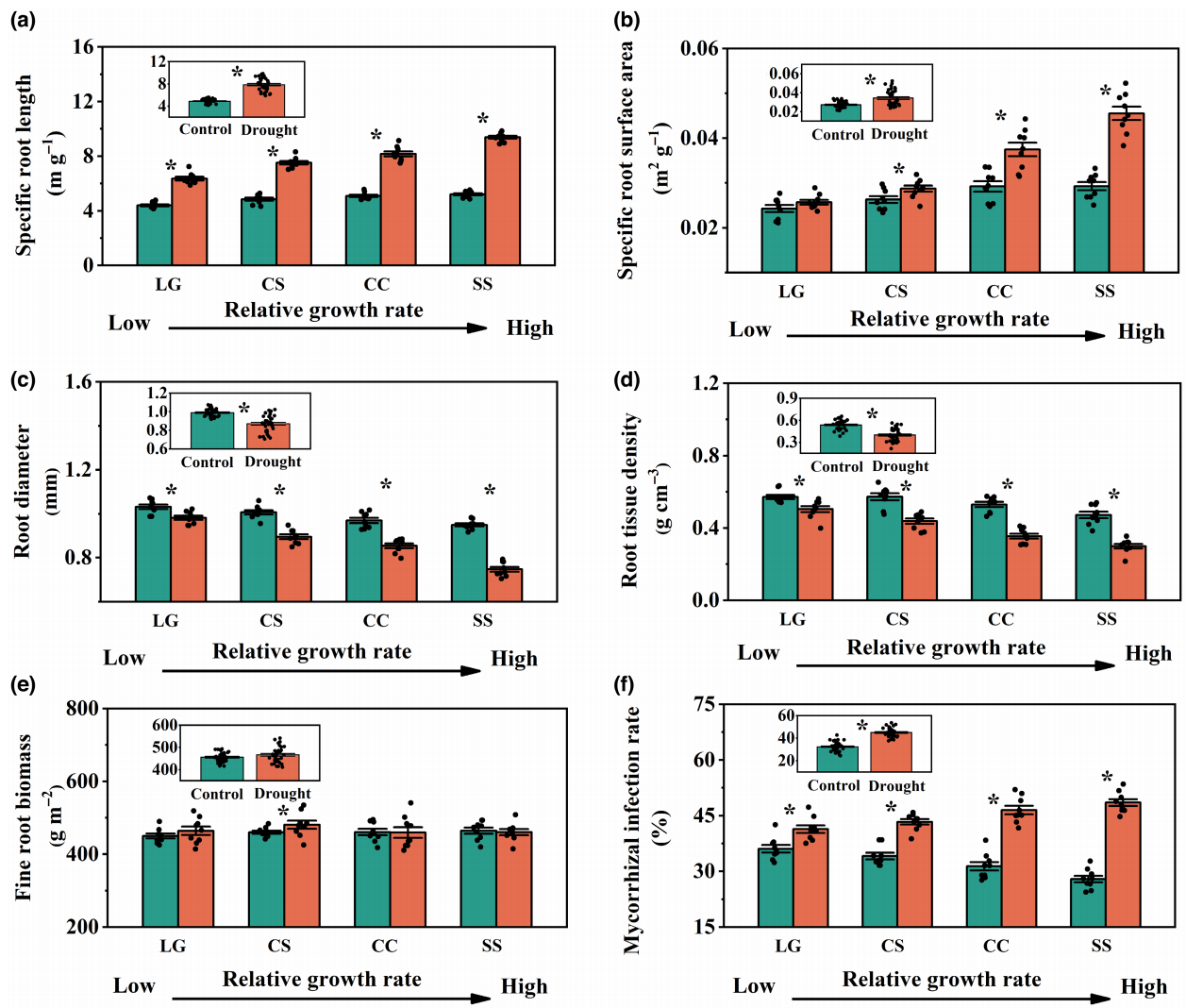
图2干旱对比根长(a)、比根表面积(b)、根直径(c)、根组织密度(d)、细根生物量(e)和菌根侵染率(f)的影响。插图显示了干旱对四种树种根系渗出率的影响(n
= 36)。对照处理和干旱处理之间的显著差异用星号表示(p<
.05)。
3.小气候、根系形态特征、土壤性质和根系分泌物的关系
相对重要性分析表明,与其他非生物或生物因素(如SOC和pH)相比,相对生长速率、根系形态特征和菌根侵染率共同解释了根系分泌率总C、糖、有机酸和氨基酸的输入速率的大部分变异(图3)。此外,菌根类型对分泌物总C、糖和氨基酸的输入速率也有显著的调控作用。干旱引起的分泌物总C和组分输入速率的变化与相对生长率、根系形态性状和菌根侵染率的变化显著正相关(图4a)。
结构方程模型表明,干旱引起相对生长速率、根系形态特征变化分别解释了分泌物总C、糖、氨基酸和有机酸输入速率变化量71%、72%、63%和73%的变异(图4b)。其中,干旱诱导的相对生长速率的变化是驱动根系分泌物总C和各组分输入速率的最重要的驱动因素(图3和图4)。
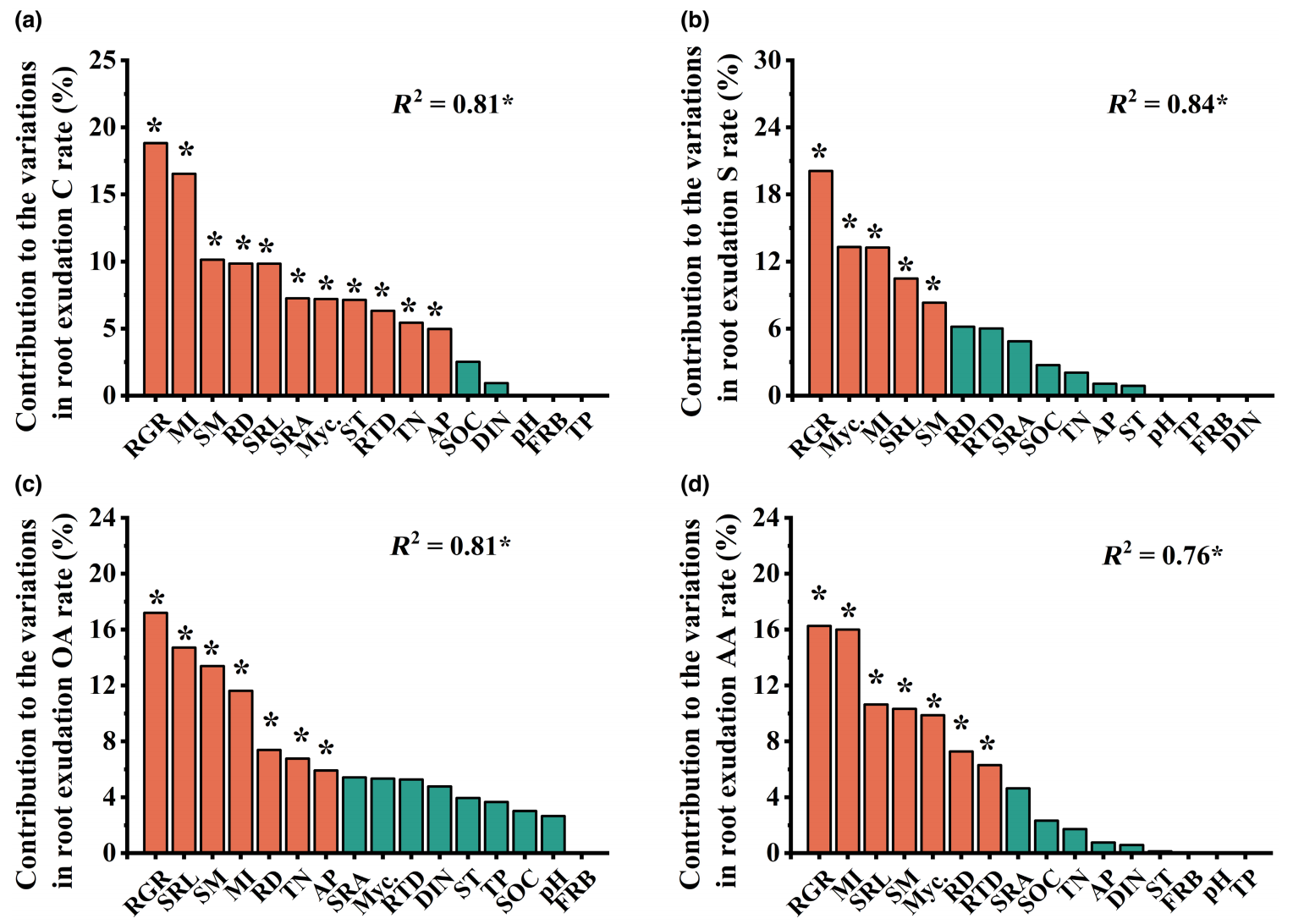
图3四种植物根系功能性状和土壤特性对根细分泌物总C、糖、有机酸和氨基酸输入速率变化的相对贡献(a-d、n
=
72)。AP:土壤有效磷;DIN:溶解无机氮;FRB:细根生物量;MI:菌根感染率;Myc:菌根类型;RD:直径;RGR:相对生长速率;RTD:根组织密度;SM:土壤水分;SOC:土壤有机碳;SRA:比根面积;SRL:比根长;TN:总氮;TP:总磷;ST:土壤温度。显著性水平用*表示(p<
.05)。
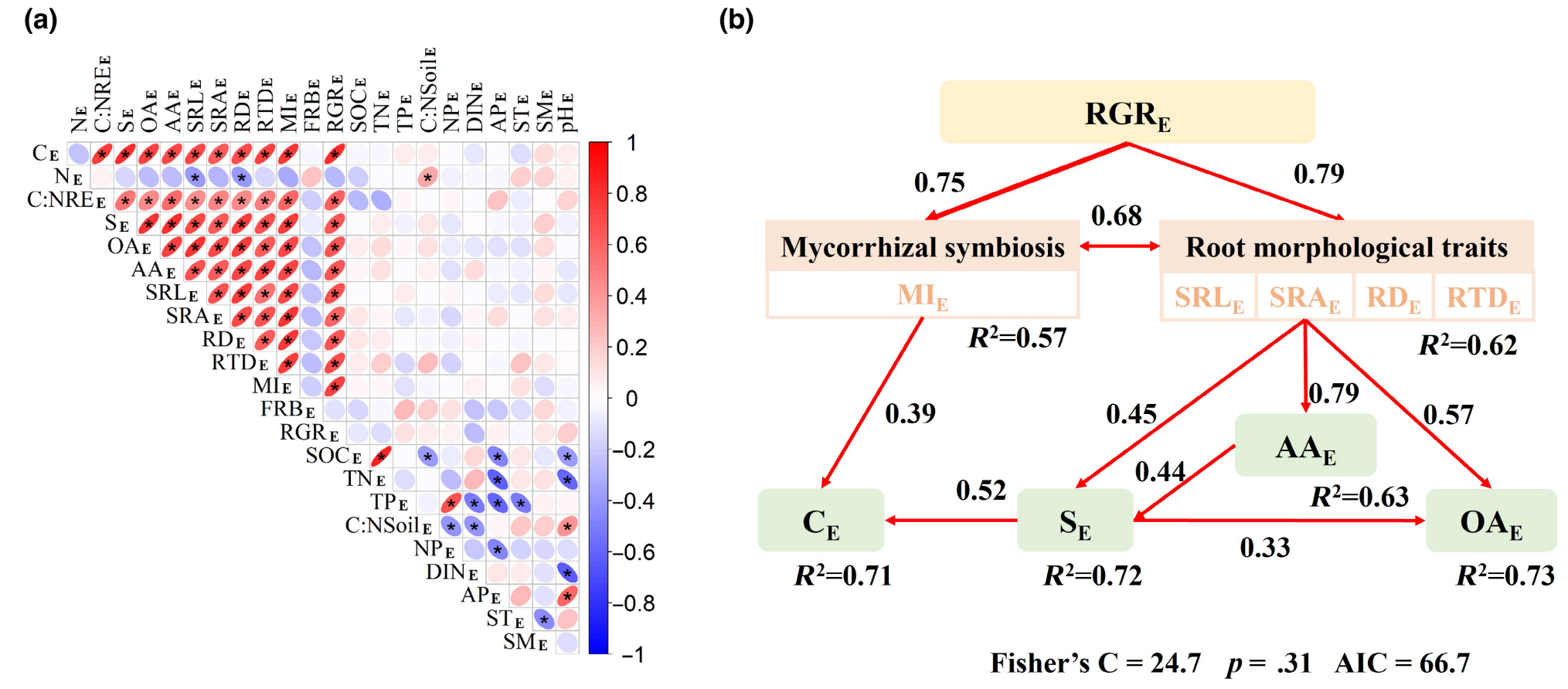
图4干旱对根系分泌物输入速率、相对生长速率、根系功能性状和土壤性质的影响之间的皮尔逊相关系数矩阵和这些变量的结构方程模型(a,b;将4个物种聚集在一起,n
= 36)。显著性水平用星号表示(p<
.05)。干旱对这些变量的影响(VariableE)计算为Variable(Drought-Control)和Variable(Control)的比值,其中Variable(Drought-Control)表示干旱和控制处理的变量之间的差异,Variable(Control)表示控制处理的测量值。