文献解读
原名:Leaf litter decay rates differ between mycorrhizal groups in temperate, but not tropical, forests
译名:在温带而非热带森林中,不同菌根群的凋落叶腐烂率不同
期刊:New Phytologis
IF:10.768
发表时间:2019.4
第一作者:Adrienne B. Keller
虽然对凋落物分解的主要影响机制已经很好地建立起来,但缺乏一个框架来预测生态系统内部和跨生态系统凋落物腐烂的种间差异。鉴于先前的研究将树木菌根与碳和营养动态联系起来,研究假设森林中的两种主要菌根群丛枝菌根(AM)和外生菌根(ECM)真菌在凋落物分解率上有所不同。实验收集了温带和热带/亚热带地区AM和ECM相关被子植物和裸子植物(>
200种)的凋落物化学和腐烂数据,并研究了凋落物腐烂速率、菌根关联、系统发育和气候之间的关系。在温带森林中,AM凋落物比ECM凋落物腐烂更快,凋落物含氮量和系统发育最能解释凋落物腐烂的变化。在亚热带森林中,不同菌根组凋落物腐烂率无显著差异,凋落物腐烂率的变化主要由凋落物中的磷引起。研究结果表明,对树木菌根关联的认识可以提高物种对生态系统过程影响的预测,特别是在AM和ECM物种通常同时出现的温带森林,为森林凋落物质量、有机质动态和养分获取之间的联系提供了一个预测框架。
植物凋落物分解是连接植物和微生物群落的基本过程,能有效耦合所有陆地生态系统中的碳(C)和养分循环。凋落物分解速率决定了腐烂植物组织中损失的营养物质多快能被生物吸收,从而决定了生态系统C循环和营养物质的储存和损失。同样,凋落物分解是确定养分有效性对植物竞争和群落结构的影响程度的重要过程。尽管几十年的研究已经阐明了影响凋落叶分解率的三个主要控制因素——气候、基质质量和土壤性质,但仍缺乏一个框架来整合这些因素来预测生态系统内部及之间的凋落叶腐烂率。这也阻碍预测物种的增减如何影响生态系统功能、生态系统服务和C循环对气候变化的反馈。
植物功能性状在本质上是相关联的,反映了由植物生理和环境控制形成的生态进化权衡。因此,在考虑复杂的动态过程(如凋落物分解)时,功能性状方法可能特别有用。一种正在引起人们兴趣的植物功能特征是菌根关联。超过90%的植物与单一类型的菌根真菌有关,每个菌根组的植物物种的优势已经被假设来反映和决定生态系统的养分循环,这是由于不同群体间植物性状和土壤性质的差异。对于森林树木,两种主要的真菌类型是丛枝菌根(AM)和外生菌根(ECM)真菌。据研究,AM和ECM相关树种在养分利用性状上存在差异,这反过来又与AM和ECM主导的生态系统中土壤C:氮(N)比、微生物丰度和活性以及N转化率的变化有关。尽管这种模式在温带和热带森林中普遍存在,但对导致这些动态的因素了解有限。
一种假说是AM和ECM树种的凋落物腐烂率的差异导致了两种菌根类型之间养分循环的差异。凋落叶腐烂的差异能够影响初级生产、养分保留和土壤有机质储存等生态系统过程。多项研究报告表明AM凋落物比ECM凋落物腐烂得更快,这与菌根群如何影响土壤C和N动态的理论是一致的。相对于ECM凋落物,许多AM树种的凋落叶木质素:N(凋落物腐烂率的表征)较低,而且腐烂率更快,特别是在它们的原本土壤中腐烂时。实验室培养研究也表明了AM凋落物相对于ECM凋落物的根和叶凋落物的腐烂速度更快。此外,当AM和ECM凋落物在同一土壤中腐烂,从而将凋落物化学效应与土壤基质性质隔离开来时,AM凋落物的腐烂速度始终快于ECM凋落物。因此,有令人信服的证据表明,在选定的森林中,不同菌根群的凋落物腐烂率可能不同。这种模式在生物群落内和整个生物群落中有多普遍还有待验证。
迄今为止,大多数关于AM和ECM树凋落物差异的研究都集中在相对狭窄的物种集合上,因此,在系统发育中菌根群效应的普遍性仍然缺乏验证。分解实验包括在同一土壤中混合AM和ECM凋落叶,可以通过纳入每个菌根类的更多物种多样性来应对这一挑战,但不能解释植物物种和相关微生物如何随着时间的推移影响土壤基质,并加强土壤性质的现有差异。鉴于生物群落中土壤性质、气候因素和物种分布的显著差异,菌根群效应可能随着纬度的不同而不同,因此有必要对菌根群对凋落物腐烂模式的影响进行跨生物群落分析。
为了解决这个问题,研究收集了温带和亚热带森林中大于200个AM和ECM树种的凋落物化学和分解率。研究假设AM凋落叶比ECM凋落叶分解更快。此外,研究假设不同菌根类型在凋落物分解方面的差异在中纬度地区比在高纬度或低纬度地区更大,在高纬度地区,气候对凋落物腐烂率的控制被认为更强。

图1数据集所包含的落叶腐烂率(k)的全球分布。
1.菌根类群对凋落物腐烂率的影响
与预测一致,在温带森林中,AM凋落叶比ECM凋落叶分解得更快(P<0.001;图2a)。相比之下,在亚热带森林中,不同菌根组的凋落物腐烂率没有显著差异(图2b)。在温带和亚热带森林中,系统发育广义最小二乘分析表明,am凋落物和ecm凋落物凋落物腐烂率的大部分变化是由物种的系统发育相关性驱动的(系统发育方差分析,p>0.05)。
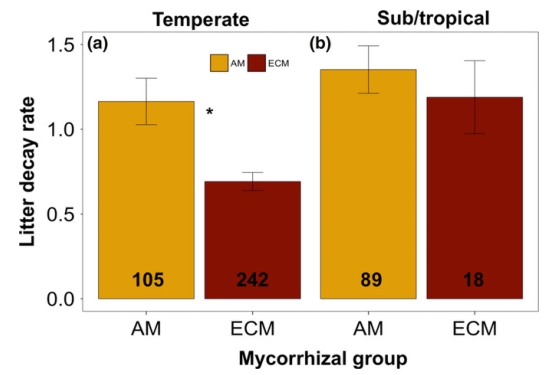
图2
(a)温带生物群落(23.5
~ 55°纬度绝对值)丛枝菌根(AM)和外生菌根(ECM)相关树木凋落叶腐烂率(k);(b)亚热带生物群落(0-23.5°纬度绝对值)
2.气候和菌根类群对凋落物腐烂率的影响
年平均气温和MAP均与凋落物k呈正相关(图3),而PET不影响凋落物k(数据未显示)。MAT和菌根组共同解释了全球凋落物k总变异的22%(调整后r2= 0.22,
P<0.001)(图3a),与AM凋落物相比,ECM凋落物的凋落物k对MAT增加的反应略强(即陡坡)(MAT和菌根组相互作用,P<0.001)。与MAT相比,MAP对数据集凋落物k总变异的解释略低(调整后r2=
0.17, P=0.02)(图3b)。这是MAP与菌根组之间强相互作用的结果(MAP与菌根组相互作用,P<
0.001),ECM凋落物腐烂率对MAP有强烈的正向反应,而AM凋落物k对MAP不太敏感。在非常潮湿的地区,AM凋落物对MAP的弱响应部分是由凋落物k的变化引起的,在这些地区,数据集中明显没有观察到ECM凋落物的腐烂;然而,在排除MAP超过3000mm
yr-1的站点的凋落物k观测后MAP和菌根组间相互作用仍显著(P<0.001)。

图3与丛枝菌根(AM)和外生菌根(ECM)相关的凋落物腐烂率(k)记录(对数转换)的全球关系:(a)年平均温度(MAT);(b)年平均降水量。
3.凋落物化学组成和菌根类群对凋落物k的影响
对于该研究数据集的子集,包括给定凋落物的凋落物化学组成和凋落物k数据,研究了凋落物化学组成如何很好地预测菌根类群之间观察到的凋落物k差异。在温带森林凋落物化学组成变化中,凋落物N(%)是凋落物k的最佳预测因子。AM凋落物腐烂率与凋落物的N呈极显著正相关(r2= 0.38, P<0.001),ECM凋落物的N与凋落物的k相关性较弱(r2=
0.05,
P<0.001)(图4a)。在温带森林中,AM和ECM凋落物的凋落物N无显著差异,而在亚/热带森林中,AM凋落物的凋落物N平均低于ECM凋落物(P
=0.03)。同时,在亚热带森林中,凋落物P是AM和ECM凋落物k的最佳凋落物化学预测因子(r2=0.19,
P<0.001)(图4b)。ECM凋落物P在温带森林(P=0.08)和亚热带森林(P=0.07)均略高。最后,在比较菌根组内生物群落差异时,发现亚/热带森林AM和ECM凋落物N值均高于温带森林(AM,P=0.076;ECM,P=0.002)。AM树种和ECM树种与凋落物P无明显差异。

图4温带森林丛枝菌根(AM)和外生菌根(ECM)树种的初始凋落物氮百分比(%
N)与凋落物腐烂率(k)的关系(a);亚热带森林AM和ECM树种的初始凋落物磷百分比(%
P)与凋落物k的关系(b)
在这里,研究表明,在温带森林中,不同菌根组的凋落物k不同,在低纬度地区的影响较弱。
综上所述,认为凋落物质量和局部分解物基质的特性协同作用,导致凋落物k中生物群系特异性菌根群差异。在温带森林中,低质量的凋落物分解和释放养分缓慢,导致土壤养分有效性低,C:养分比高。这反过来又形成了一个代谢率低的分解者群落,能够获得低质量的基质。如果低土壤养分有效性提高了叶片吸收效率,进一步降低了凋落物养分浓度,并加强了低养分环境中植物凋落物缓慢的分解,则这种植物-土壤-微生物正反馈循环可能会进一步放大。植物凋落物特征、土壤肥力和分解者群落之间的这种共变异突出了将菌根关联视为一种综合特征的效用,它具有预测物种对生态系统过程(如凋落物分解)的特定影响的能力。这些菌根群综合征在低纬度森林中减弱甚至逆转的程度值得进一步研究。随着环境变化迫使森林植物群落组成发生大规模变化,需要采用这样的功能方法来提高物种对生态系统功能的影响,从树木到林分和生态系统规模,以及更好地预测植物群落和气候周期之间的反馈。
论文id:https://doi.org/10.1111/nph.15524
氨基糖、木质素、PLFA
磷组分、有机酸、有机氮组分
微生物量碳氮磷、同位素等
其他土壤、植物、水体等常规检测指标均可测定,欢迎咨询相关工作人员了解详情
服务热线:028-85253068
18682730999(微信同号)
公司地址:成都市成华区四川检验检测创新科技园2号楼14层