原名:In situ 13CO2 labeling reveals that alpine treeline trees allocate less photoassimilates to roots compared with low-elevation trees
译名:原位13CO2标记表明,与低海拔树木相比,树线树木分配给根系的光合同化物更少
期刊:Tree Physiology
IF:4.561发表时间:2022.4
第一作者:Yu Cong
背景:碳(C)分配对高山树线树木的生存和生长起着至关重要的作用,但目前对其了解甚少。
方法:利用原位13CO2标记技术,我们研究了位于树线和低海拔的树木叶片光合作用和13C标记的光同化物在不同组织(叶片、小枝和细根)中的分配。还测定了各组织非结构性碳水化合物(NSC)浓度。
结果:与低海拔树木(LETs,1700 m a.s.l.)相比,树线树木(TLTs,2000 ma.s.l.)的光合作用没有受到明显的抑制,但TLTs向地下分配新同化碳(C)的比例更低。新碳在TLTs叶片中的停留时间(19天)长于LETs(10天)。我们还发现TLTs组织中新碳的总体密度更低。
结论:TLTs可能具有光合补偿机制,以抵消恶劣的树线环境(如,较低的温度和较短的生长季节)对碳获取的负面影响。
树线较低的温度可能会限制碳库活性和韧皮部的向下运输,而较短的树线生长季节也可能会导致根系生长提前停止,因此碳库强度降低,这可能最终导致碳库组织中新碳密度降低,最终限制高山树线树木的生长。
高山树线是陆地生态体统最明显的植被边界,对全球和区域环境变化高度敏感。树线附近的低温、较低的CO2分压、强风和强烈紫外线辐射可能会抑制树木生理过程,从而限制高山树线交错带的光合作用、生长和生存。
光合产物的分配以及向各组织的投资是树木碳平衡的重要方面。NSC的组织水平是促进生长、维持代谢和碳储存能力的核心,反映了树木碳同化、分配和消耗之间的平衡。以往许多研究发现极端环境条件下组织NSC浓度增加。
然而,对于极端环境下组织NSC升高是由于库需求低于光合供应,或者是由于在恶劣环境条件下选择主动积累用于维持树木功能,目前尚不清楚。
树木全株尺度的碳分配受到各种环境因素的影响,如干旱、遮阴、养分限制以及物种竞争。树木碳分配在适度胁迫环境下遵循“功能平衡假说”,即植物为加强对最具限制性资源的获取,通常倾向于将碳分配给限制的器官。然而,在极端胁迫环境下,树木碳分配格局也可能不遵循“功能平衡假说”。
长时间的碳分配格局主要通过生物量分配来评估,而短时间尺度上则主要通过13C标记来实现。虽然13C标记技术早已被应用于植物碳分配研究中。但只有很少的研究使用该技术定量分析高寒树线树木中新同化碳的分配格局。因此,为了更好地理解树线形成的机制,需要使用最新的方法和技术,精确、定量地评估树木的碳合成和分配格局。
在本研究中,我们对生长在高山树线和低海拔的白桦进行了全树13CO2脉冲标记,跟踪13C示踪物在植物内部、土壤和大气中的转移。此外,我们还测定了叶片、小枝和根中的NSC浓度。
我们假设:(1)树线树木(TLTs)的光合作用能力与低海拔树木(LETs)相当;(2)由于TLTs在夏季对NSC的主动储存,TLTs在夏季会将更多的新同化碳分配到根系中,因此TLTs根中NSC浓度会高于LETs。
1.树木大小、生物量和光合能力
树线树木(TLTs)的基径、树高、总生物量以及年平均树轮宽度均显著低于低海拔树木(LETs;表1)。然而TLTs的最大光合速率(Amax)和气孔导度(gs)显著高于LETs(表2)。TLTs的根冠比显著高于LETs,但单位面积叶片重(LMA)和每树总叶面积没有显著从差异。
表1白桦树在不同海拔的大小、年龄和生物量
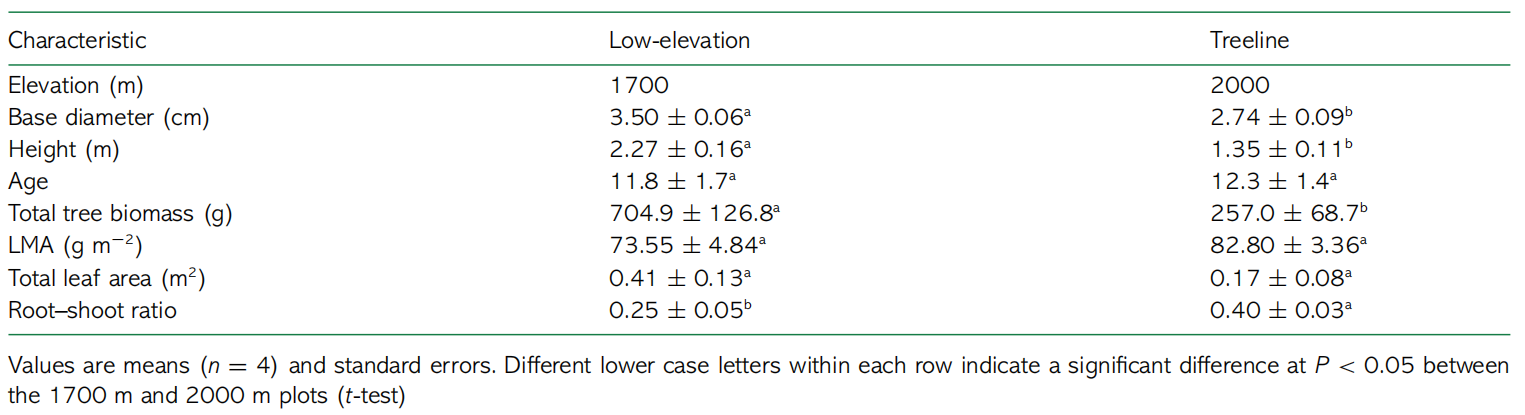
表2不同海拔树木组织中最大光合速率(Amax)和气孔导度(gs)以及NSC浓度

2.13C富集量(%)
在大部分采样日期,TLTs叶片中的13C富集度显著高于LETs(P<0.05;图4a),但叶片13C富集度下降速率低于LETs。在小枝中,TLTs的13C富集度峰值比LETs出现得更晚(图4b)。在任何取样时间,细根中13C富集度在TLTs和LETs之间没有显著差异(图4c),但TLTs的13C富集度峰值比LETs出现得更晚。土壤中13C富集度较低,且两个海拔之间没有显著差异(图4d)。
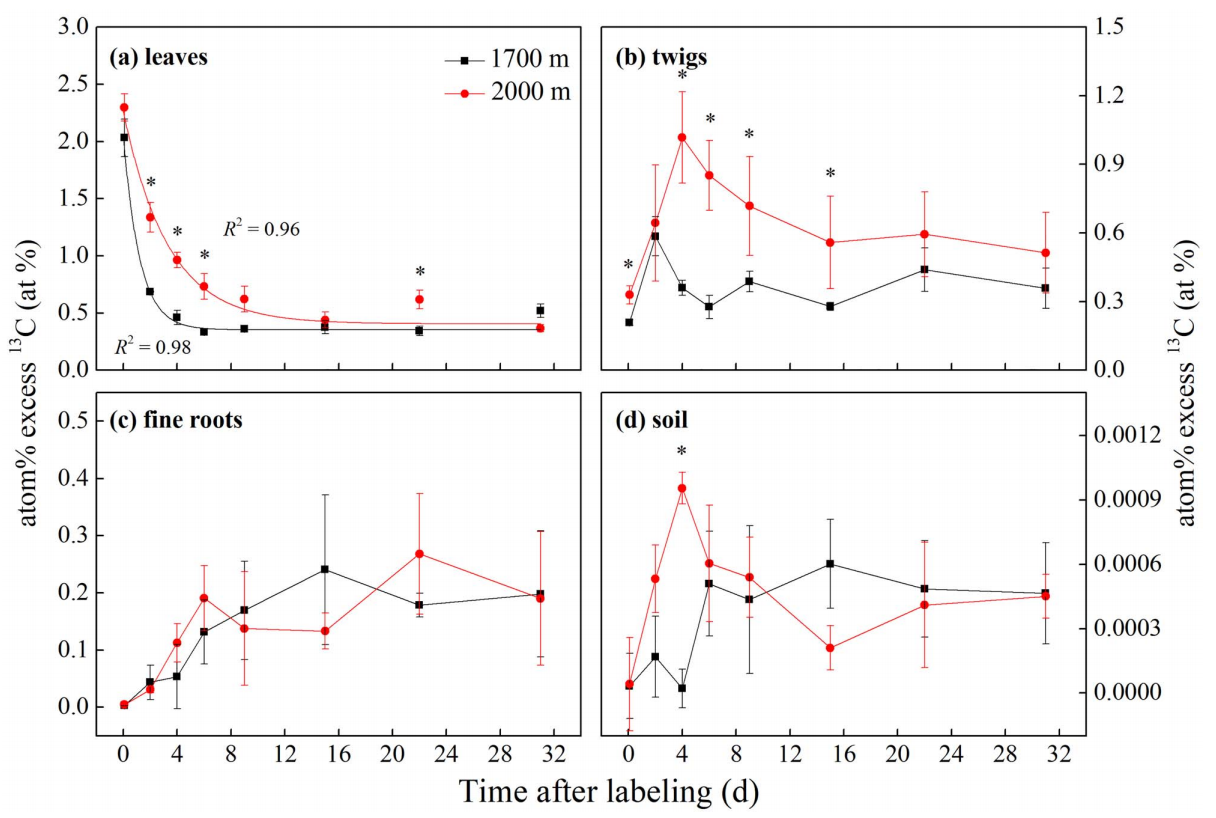
图413C富集度(%)在不同海拔的白桦树各组织中的时间变化动态:(a)叶片;(b)小枝;(c)细根;(d)土壤。*表示不同海拔在0.05水平上具有显著差异。
3.可溶性13C富集度(%,表征NSC中13C浓度)和NSC浓度
叶片可溶性13C富集度在TLTs和LETs之间没有显著差异(图5a)。小枝中,TLTs的可溶性13C富集度总体上高于LETs,但只在第15天达到显著水平(图5b)。与之相反,在细根中,TLTs的可溶性13C富集度在任何取样时间均低于LETs(图5c)。
叶片和小枝中的NSC浓度不随海拔高度而变化,但TLTs的根系NSC浓度显著高于LETs(表2)。但总体上,TLTs的可溶性13C含量低于LETs(图6)。
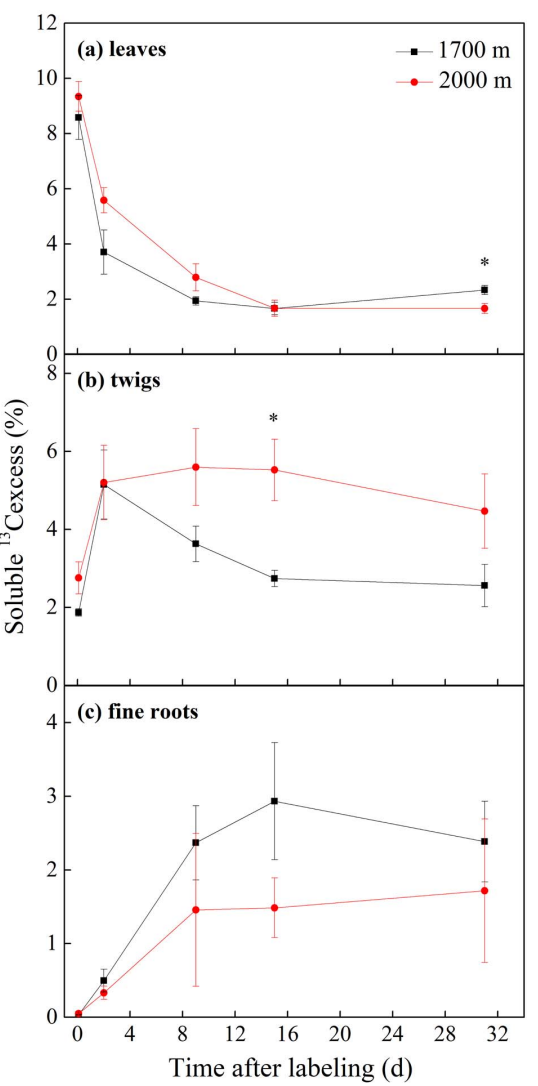
图5可溶性13C富集度(%)在不同海拔的白桦树各组织中的时间变化动态:(a)叶片;(b)小枝;(c)细根。*表示不同海拔在0.05水平上具有显著差异。
图6可溶性13C含量(mg13C)在不同海拔的白桦树各组织中的时间变化动态:(a)叶片;(b)小枝;(c)细根;(d)全株的。*表示不同海拔在0.05水平上具有显著差异。
4.单位投影面积的13C密度(mg 13C m-2)
考虑到树木生物量的差异,我们根据单位生物量或单位投影地面面积对图6中显示的可溶性13C含量进行了标准化。同样地,总的趋势是标记后TLTs组织中的可溶性13C密度(即单位投影表面积)低于LETs(图7)。
对于呼吸而言,在低海拔(1700m),基于叶面积和树木投影面积的叶片呼吸消耗13C量倾向于高于树线(2000m; 图8a,c),但只在标记后第二天具有显著差异。土壤呼吸消耗的13C量也表现出一致的趋势(图8b,d)。
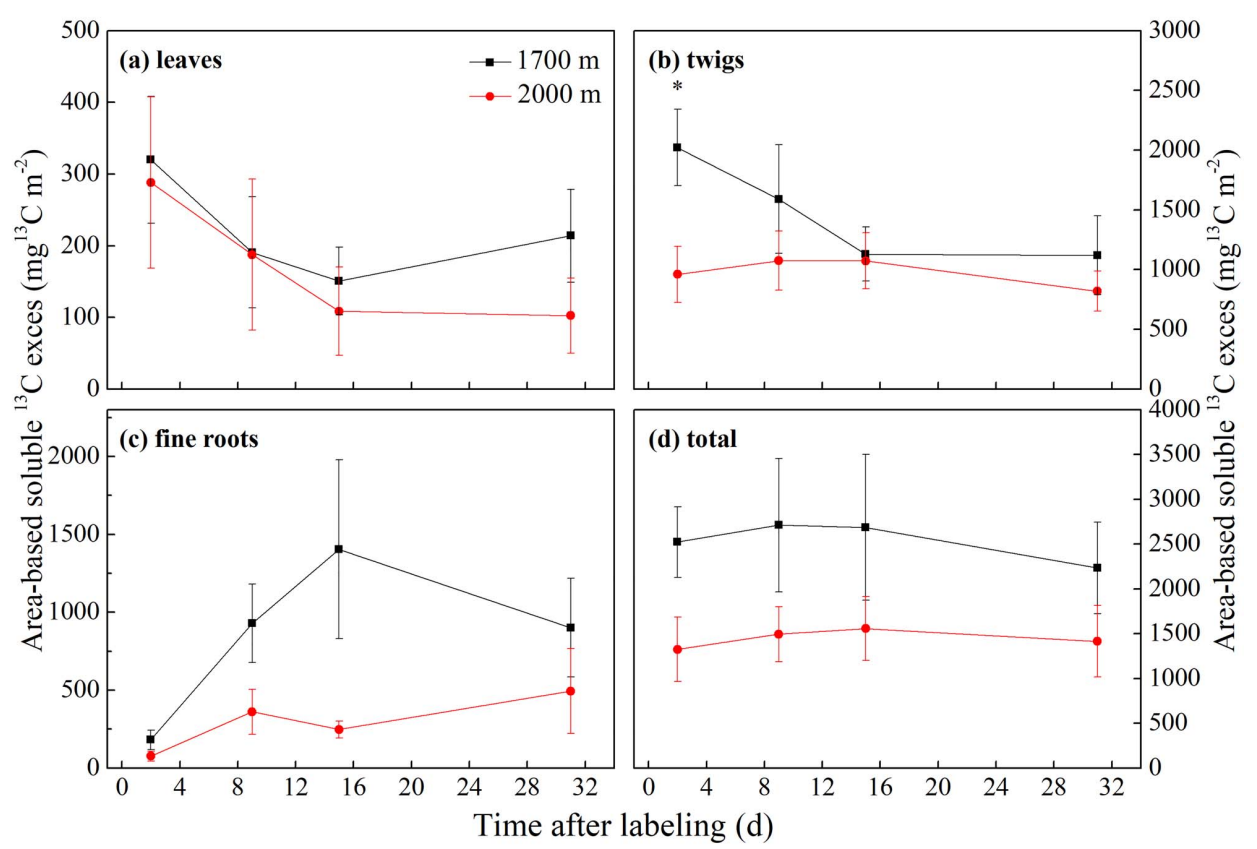
图7单位投影面积13C密度(mg13Cm-2)在不同海拔的白桦树各组织中的时间变化动态:(a)叶片;(b)小枝;(c)细根;(d)全株。*表示不同海拔在0.05水平上具有显著差异。
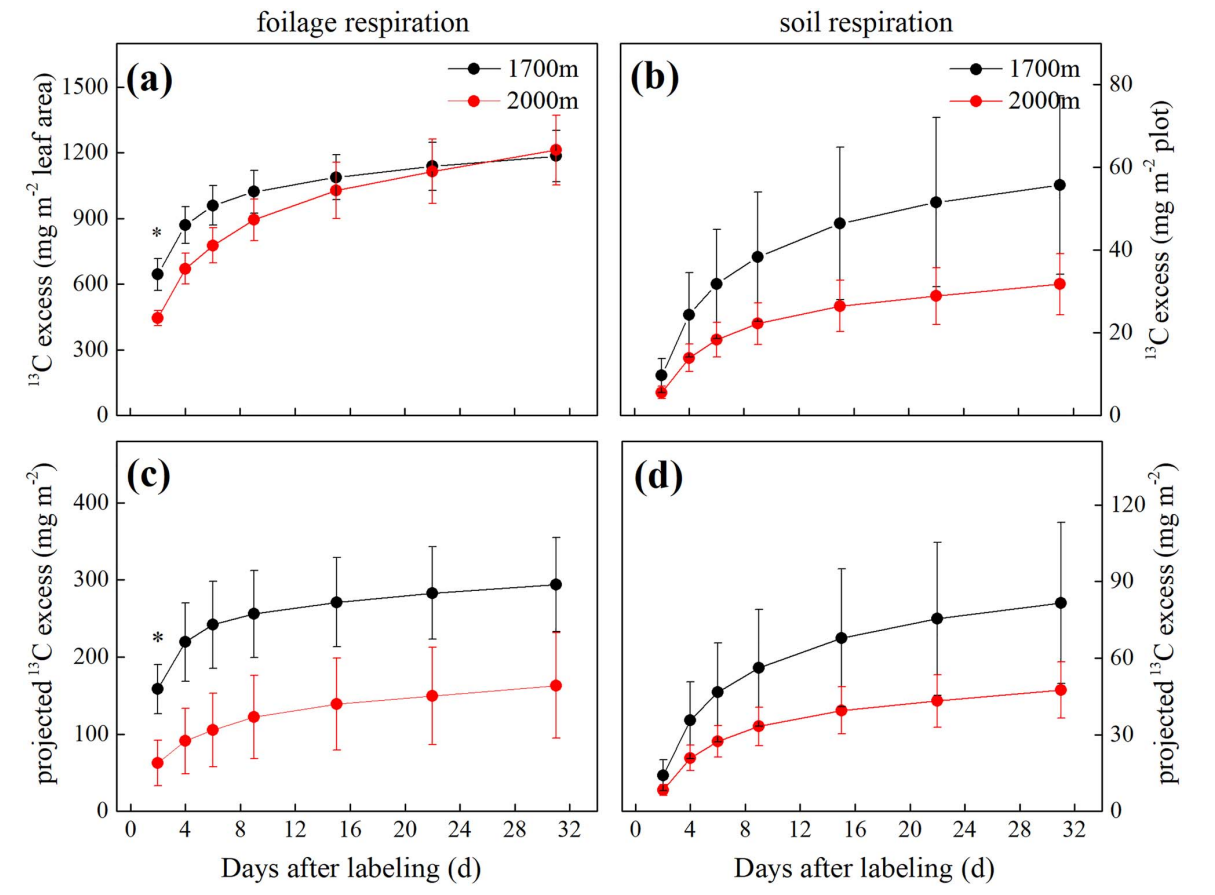
图8基于叶面积(a)或投影地面面积(c)的叶片呼吸导致的13C损失(平均值±SE;n=4/海拔),基于小区面积(c)或投影地面面积(d)的土壤呼吸导致的13C损失。
1.与假设1一致,树线树木(TLTs)的光合作用相比低海拔树木(LETs)并没有表现出明显的劣势,表明树木生长在低温恶劣环境中的具有光合作用补偿机制。
2.与假设2相反,尽管本研究的海拔仅相差300 m(1700和2000 m),位于树线的树木(TLTs)向地下分配的新碳显著低于低海拔的树木(LETs)。这可能是TLTs和LETs之间不同的生长条件(主要是温度和土壤水分条件)导致的库活性、韧皮部C运输速度和根系物候期差异的综合结果。
3.本研究表明,TLTs组织中的可溶性13C密度总体上低于LETs。这为树线形成的碳生理机制提供了新的见解,并为最近的研究结果提供了碳生理学证据,即低组织碳密度导致的低生长速率以及与温度相关的较短生长季节长度共同决定了高海拔树木的生长。
论文id:https://doi.org/10.1093/treephys/tpac048
氨基糖、木质素、PLFA
磷组分、有机酸、有机氮组分
微生物量碳氮磷、同位素等
其他土壤、植物、水体等常规检测指标均可测定,欢迎咨询相关工作人员了解详情
服务热线:028-85253068
18682730999(微信同号)
公司地址:成都市成华区四川检验检测创新科技园2号楼4楼