原名:Network analysis and subsequent culturing reveal keystone taxa involved in microbial litter decomposition dynamics
译名:网络分析和后续培养揭示了参与微生物凋落物分解动力学的关键类群
期刊:Soil Biology and Biochemistry
IF:8.5
发表时间:2021.6
通讯作者:徐阳春
主要单位:南京农业大学资源与环境科学学院
土壤中植物凋落物的分解由定殖在凋落物残体上的细菌和真菌等微生物驱动,因此,细菌和真菌群落的相互作用可以揭示木质素的分解机制。以往的研究主要是在微生境、异地条件或单一土壤生态系统中研究凋落物分解的微生物群落。而本研究通过为期12周的室内凋落物(秸秆)分解实验,探讨三种不同利用类型(林地、农田和弃耕地)的土壤中凋落物分解与酶活性和微生物群落变化的关系。本研究发现:(1)三类土壤中林地凋落物的分解程度最高;(2)然后,我们用多种方法证明了这是由微生物群落决定的,林地土壤微生物群落具有更高活性的木质素分解酶,更高的微生物多样性,以及不复杂但更专门化的网络。细菌中的Chryseobacterium(金黄杆菌属)和真菌中的Fusarium(镰刀菌属)、Aspergillus(曲霉菌属)、Penicillium(青霉菌属)是三类土壤微生物网络中的关键类群;(3)我们随后开展了分离培养实验,进一步证实了这些关键类群具有高的凋落物分解能力和酶活性。本研究首次验证了微生物关键类群在凋落物分解中的作用,网络分析与培养实验的结合被证明是筛选微生物关键类群的可选模式。总体而言,我们的结果说明,土地利用类型通过土壤微生物群落的组成和网络结构进而影响凋落物的分解。我们的研究还揭示了特定的关键微生物类群参与了凋落物的分解,未来或许可以利用这些关键类群来调控土壤生态系统中木质素的分解。
1. 凋落物分解及其质量的变化随着时间的推移,土地利用类型对凋落物分解有明显影响,在第2周和第12周,林地的凋落物分解率最高,而弃耕地的凋落物分解率最低。在第12周后,林地、农田和弃耕地凋落物的分解率分别达到63.42%、53.75%和50.38%(图1-a)。林地凋落物分解常数显着高于耕地和弃耕地。土地利用类型和时间对凋落物分解都有显著影响。不同土地利用类型的凋落物组成也有显著变化(图1 b-d)。土地利用类型和时间都会影响凋落物质量的变化。
图1. 林地、农田和弃耕地凋落物分解及质量变化
2. 酶活性的变化不同土地利用类型的纤维二糖水解酶、β-葡萄糖苷酶、β-木聚糖酶和漆酶的活性也存在显著差异(图2 a-d)。在整个采样期间(包括初始时间),林地中的所有酶活性均显著高于农田和弃耕地,但是每种酶的活性表现出不同的趋势。四种酶活性的总酶活性(Z-score)显示:林地的总酶活性显著高于其他两个位点(图S3)。木质素酶活性与凋落物分解呈显著的正相关关系(P<0.001,图2-e)。具体而言,β-葡萄糖苷酶与三种土壤的纤维素和半纤维素显著相关。漆酶与木质素也显著相关。土地利用类型和时间都显著影响凋落物质量的变化。这些结果表明,三种土壤的凋落物分解与相关酶活性之间存在很强的相关性。
图2. 林地、农田和弃耕地中(a)纤维二糖水解酶、(b)β-葡萄糖苷酶、(c)β-木聚糖酶和(d)漆酶的变化。(e)四种纤维素酶活的总和(Z-score)与凋落物分解的关系
3. 凋落物分解过程中微生物群落的演替细菌和真菌群落都随时间显著变化。富集培养2-12周后,秸秆表面的微生物群落与初始样品(未培养前)的微生物群落明显不同。在前期和后期,林地土壤的细菌总量(绝对丰度)都显著高于农田和弃耕地(图3-a)。凋落物开始分解后,细菌的OTU丰富度立即下降(图3-c),表明掺入秸秆后来自土体的细菌群落开始发挥作用(分解秸秆)。随着分解的进行,细菌OTU丰富度随时间增加,在第6周和第8周达到最高,然后再下降(图3-c)。林地土壤的细菌群落与农田和弃耕地土壤的细菌群落不同(图3-e),并且这些差异在整个采样期间都十分明显。凋落物分解过程中的优势细菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)(图3-g)。三种土壤中这些优势菌门的变化趋势不同。另外,在林地中,只有细菌的β多样性(PCoA1)与木质素呈显著负相关关系。这些结果表明,在凋落物分解过程中细菌群落随不同生态系统类型(土壤类型)而变化。一般来说,真菌群落只受土壤类型的影响。在所有时间点,林地真菌的绝对丰度显著高于农田和弃耕地(图3-b)。与细菌群落类似,在第2周真菌的OTU丰富度显著下降(图3-d)。在第2周和第6周,林地真菌的OTU丰度显著高于其他两种土壤(图3-d)。林地真菌的群落结构与农田和弃耕地也显著不同(图3-f),这种差异在第0、2、6和12周的表现一致。凋落物分解过程中(包括三种土壤和所有采样时间)的优势真菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)(占总序列的70-99%;图3-h)。在第4周和第6周,担子菌门(Basidiomycota)在农田和弃耕地中占主导地位,包括Coprinopsis和Psathyrella属。
图3. 凋落物分解实验(12周)中,林地、农田和弃耕地土壤细菌和真菌的总丰度、多样性、群落结构及分类组成的变化
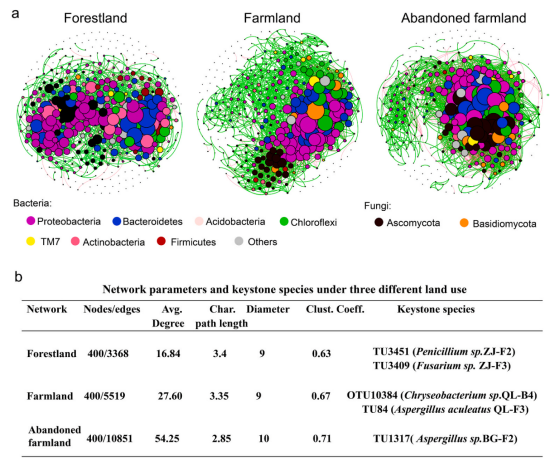
4. 微生物共生网络及关键类群三种土壤的网络复杂度差异较大。与农田和弃耕地相比,林地微生物网络的复杂度较低(图4-a和b)。弃耕地的微生物网络最为复杂,其边数、平均度和聚类系数均高出(林地微生物网络)2倍(图4-b)。关键微生物类群主要属于细菌中的放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria),以及真菌中的子囊菌门(Ascomycota)。删去关键类群OTU后,我们重构了三种土壤的共生网络,以评估其对网络的影响。结果表明,如果没有关键类群的OTU,微生物网络就会变得更简单。为了进一步验证这些关键类群,我们将筛选出60个关键类群OTU与可培养的34株细菌和17株真菌菌株进行了系统发育地位匹配。结果显示,60株中有5株为可培养的菌株,其中林地(TU3451,Penicillium sp.ZJ-F2;TU3409,Fusarium sp.ZJ-F3)、农田(OTU10384,Chryseobacterium sp.QL-B4;TU84,Aspergillus aculeatus QL-F3)和弃耕地(TU1317,Aspergillussp.BG-F2)(图4-b)。
5. 潜在关键物种的(凋落物)分解效能。我们进一步对这5个关键菌株(Penicillium sp.ZJ-F2、Fusariumsp.ZJ-F3、Chryseobacterium sp.QL-B4、Aspergillusaculeatus QL-F3、Aspergillus sp.BG-F2)的凋落物分解能力进行了评估。结果发现,来自林地的Penicillium sp.ZJ-F2菌株的凋落物分解能力显著高于其他两种类型的土壤(图5-a)。此外,Fusariumsp. ZJ-F3菌株和Aspergillussp.BG-F2菌株的凋落物分解能力显著高于Chryseobacterium sp.QL-B4和Aspergillusaculeatus QL-F3菌株(图5-a)。Penicillium sp. ZJ-F2菌株还具有最高的纤维二糖水解酶、β-木聚糖酶、β-葡萄糖苷酶和漆酶活性(图S13)。用Z-score计算四种酶活的总活性,结果发现:Penicilliumsp. ZJ-F2菌株的Z-score最高、凋落物分解能力最强;Chryseobacterium sp.QL-B4的Z-score最低、凋落物分解能力最差(图5-b)。相关性分析进一步证实了凋落物分解与关键类群(凋落物分解与Z-score值正相关)之间的相关性(图5-c)。这些结果表明,可通过构建共生网络初步筛选潜在的关键微生物类群以进一步探索相关的微生物功能。
图5.秸秆液体发酵实验(7天)中,凋落物分解的关键类群和四种纤维素酶活的总和(Z-score)
在凋落物分解过程中,木质素分解酶活性、微生物群落结构和共生模式(网络)发生了变化,这些变化受土地利用类型的影响。具体而言,林地土壤凋落物分解程度较高的原因是木质素降解酶活性较高、微生物多样性较高、微生物网络不那么复杂但更为专门化。因此,我们的结果表明,土地利用类型影响的土壤微生物演替介导的土壤凋落物分解。基于共生网络分析和后续的分离培养实验,我们确定了土壤凋落物分解相关的关键类群。这些类群表现出很强的凋落物分解能力和酶活性。网络分析与培养实验的结合是筛选微生物关键类群的可选模式。此外,强调了通过网络评分确定的关键分类群可以通过培养筛选来表征。此外,这是一次利用统计经验验证微生物工程和代谢模型中关键类群的成功尝试。