
译名:北方针叶林自然氮供给梯度下外生菌根菌丝体的碳-氮关系
原名:Carbon-nitrogen relations of ectomycorrhizal mycelium across a natural nitrogen supply gradient in boreal forest
期刊名称:New Phytologist
影响因子: 10.151 (2020)
第一作者:Höberg, M, N
摘要:树木向外生菌根(ECM)真菌供应的光合作用固定碳(C)是随着植物氮(N)供给的增加而减少,然而植物氮供给的变化是如何影响真菌营养及其生长仍有待阐明。作者在一个自然土壤N供给梯度下的北方针叶林样地,采用放置装填石英砂的网袋的方法,加入有机N(15N-,13C-标记)源或不加,测定ECM外延菌丝的生长及其对C和N的利用。研究发现:随着N供给的增加,菌丝C:N比下降。在低N供给水平下,但外加N促进菌丝生长。菌丝对外加C、N的吸收与C、N的供给呈反比关系。当背景N含量较低时,菌丝对外加N的利用越高;当光合固定C较低时,菌丝对外加C的利用越高。本文认为当土壤N缺乏且乔木对ECM真菌的地下碳分配较高时,ECM的生长受N限制;而当土壤N供给较高且乔木对ECM真菌的碳分配较低时,ECM真菌的生长受C限制。这说明在低养分供给情况下,北方针叶林ECM真菌在土壤N留存中发挥重要的作用,而在养分丰富的情况下,其重要性下降。
研究背景:
大量的研究表明外加N促进了北方温带ECM森林的植被生产力。然而,在野外原位的植物-土壤条件下,ECM真菌对N供给变化的生理响应的认识仍十分缺乏。通常,植物生长受到N限制,而土壤微生物则受到C限制。ECM真菌依赖于宿主植物的光合C供应,这种供应的减少可能导致ECM的C缺乏并改变其生物量、物种丰富度和群落组成。目前,ECM真菌树木仅仅作为树木根系系统的延伸,或者其生长于宿主一样,也受到大多数北方森林土壤低N供给的限制,这仍然是一个悬而未决的问题。由于树木地下C分配和养分供给的季节和空间差异性,ECM共生体对N供给变化的响应可能更加敏感且多样化。本研究聚焦于不同碳、氮供应条件下土壤中ECM外延菌丝的碳氮关系及生理特性。我们假设,当树木响应低N有效性,光合作用产物的地下C分配相对较高,ECM与植物同时受到N-限制,N添加能刺激ECM菌丝的生长;而当土壤N有效性高时,由于树木的地下C分配量低,菌丝生长受到C-限制。研究旨在检验:(1)氮贫乏森林ECM菌丝的生产是否受到N限制?(2)
随着自然氮供应的增加和树下碳分配的减少,菌丝生长的N限制是否发生变化并逐渐转向碳限制。
主要结果:
1) 两种评估ECM真菌侵染(可视化直接观测vs. 真菌生物量干重)方法的结果是高度相关的(图 2a),对照处理下ECM生物量呈驼峰型变化,ECM菌丝生物量在中等氮供应水平达到峰值,而施氮对ECM真菌生物量的影响取决于土壤初始N有效性(图2b, c)。在低养分有效性水平下,施氮使ECM真菌生物量(干重)增加85.4%;在中等和高N有效性水平下,施氮处理对真菌生物量没有显著影响;且高N有效性 水平下,菌丝干重在对照和施氮处理下都极低。
2) ECM菌丝N浓度随着N供给梯度的升高而增加,施氮提高各梯度下菌丝N含量(图 3a)。随着N供给梯度的升高,对照处理下菌丝C:N比逐渐下降(从37.6降至10.1),而施氮后菌丝C:N比保持恒定(7.6±0.6)(图3b)。施氮显著的改变各梯度下的菌丝N含量与C:N比。 对照处理下网袋中ECM菌丝的δ13C从低N供给水平下的−28.5‰增加到中N供给水平下的−26.7‰,然后在高N供给水平下再次降低到−28.6‰(图3c),而与此同步地菌丝δ15N从5.5‰下降到0.2‰(图 3 c, d)。施氮降低各N供给梯度下菌丝δ13C和δ15N。在各处理下,菌丝δ13C与δ15N均无显著相关性,但对照处理下菌丝δ15N与菌丝C:N比正相关(图3 e, f).
3) ECM生物量C有70%~93%来源于外源资源(即植物光合产物)。随着养分供给的增加,ECM菌丝从更高的外源C和内源N利用(图4a, d)转向更多的内源C和外源N利用(图 4b, c)。菌丝C含量与外源C(图 5a)和内源N相关,因此,内源N的同化与外源C密切相关(图 5b)。菌丝N与外源N相关(图5c),而内源C的同化与上述变量均不相关。
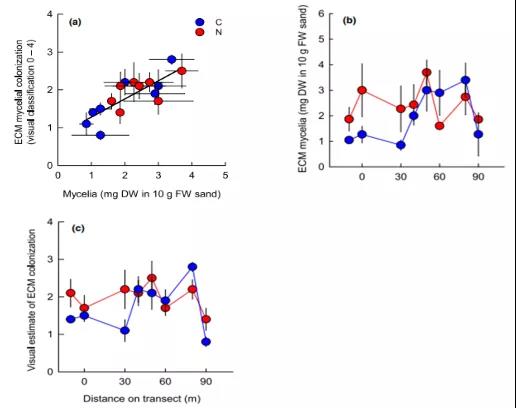
Fig. 2 瑞典北部Betsele地区天然N供给和生产力梯度下外生菌根侵染率(观测)与外延菌丝、根状菌索生物量的
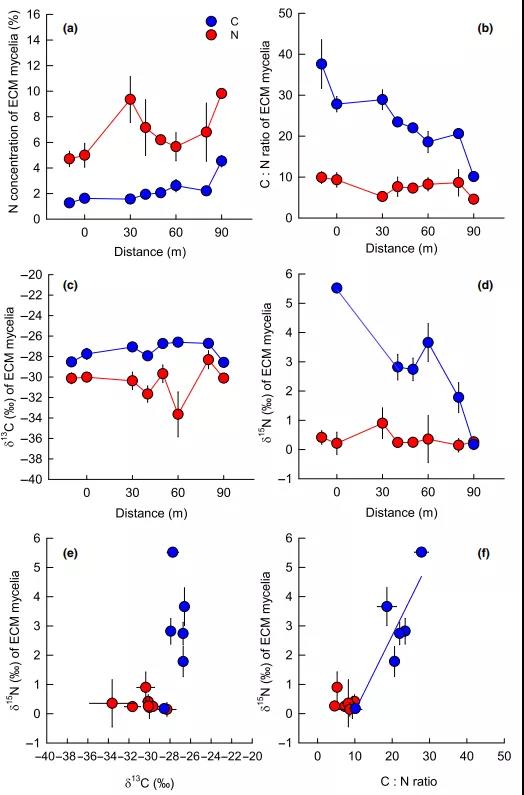
Fig. 3瑞典北部外生菌根(ECM)菌丝和根状菌索的碳(C)和氮(N)关系。
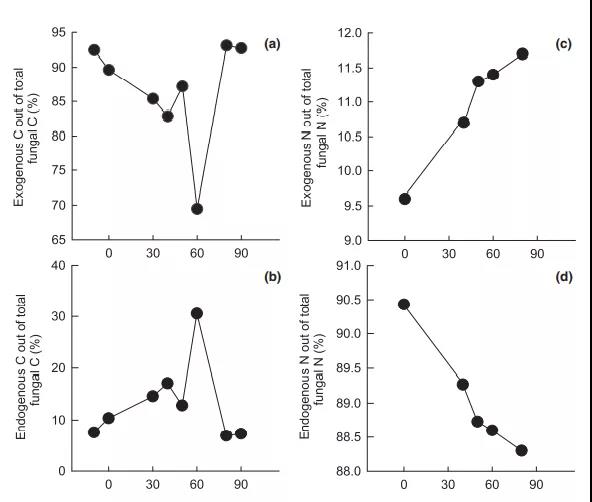
Fig. 4在瑞典北部Betsele地区沿自然氮供给梯度下外生菌根真菌碳(C)和氮(N)利用的 稳定同位素混合模型
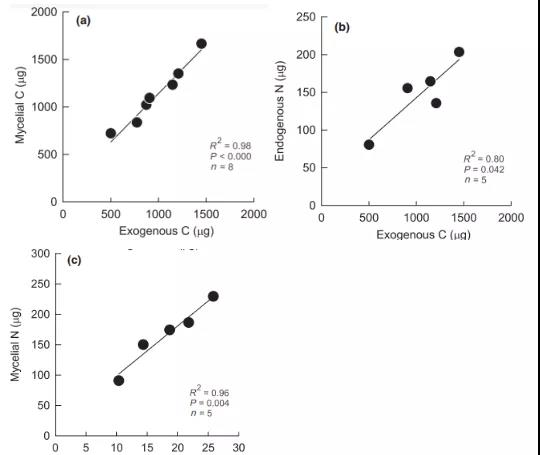
Fig. 5. 外源C与(a)菌丝C,(b)内源N,以及外源N与(c)菌丝N的关系。