Abstract: Understanding the effects of changing climate and long-term human activities on soil organic carbon (SOC) and the mediating roles of microorganisms is critical to maintain soil C stability in agricultural ecosystem. Here, we took samples from a long-term soil transplantation experiment, in which large transects of Mollisol soil in a cold temperate region were translocated to warm temperate and mid-subtropical regions to simulate different climate conditions, with a fertilization treatment on top. This study aimed to understand fertilization effect on SOC and the role of soil microorganisms featured after long-term community incubation in warm climates. After 12 years of soil transplantation, fertilization led to less reduction of SOC, in which aromatic C increased and the consumption of O-alkyl C and carbonyl C decreased. Soil live microbes were analyzed using propidium monoazide to remove DNAs from dead cells, and their network modulization explained 60.4% of variations in soil labile C. Single-cell Raman spectroscopy combined with D2O isotope labeling indicated a higher metabolic activity of live microbes to use easily degradable C after soil transplantation. Compared with non-fertilization, there was a significant decrease in soil α- and β-glucosidase and delay on microbial growth with fertilization in warmer climate. Moreover, fertilization significantly increased microbial necromass as indicated by amino sugar content, and its contribution to soil resistant C reached 22.3%. This study evidentially highlights the substantial contribution of soil microbial metabolism and necromass to refractory C of SOC with addition of nutrients in the long-term.
摘要:了解气候变化和人类长期活动对土壤有机碳(SOC)的影响以及微生物的调控作用是维持农业生态系统土壤C稳定的关键。本研究进行了一个长期土壤移置实验即将寒温带的黑土迁移至暖温带和中亚热带地区以模拟不同的气候条件,并在顶部进行施肥处理。研究旨在了解在温暖气候条件下长期群落培养后,施肥对土壤有机碳的影响以及土壤微生物的作用。土壤移置12年后,施肥导致SOC减少,其表现为芳香C的增加,以及氧烷基C和羰基C的减少。用叠氮溴化丙锭去除死细胞中的DNAs后,对土壤中活的细菌群落进行了分析,发现其网络模块化解释了60.4%的土壤易分解C变化。单细胞拉曼光谱结合D2O同位素标记表明土壤移置后活微生物对易降解碳的代谢活性较高。与不施肥相比,气候变暖与施肥条件下,土壤α-和β-葡萄糖苷酶活性显著降低,微生物生长延缓。此外,施肥显著增加了土壤微生物残体(necromass,以氨基糖含量为指标),其对土壤顽固性碳的贡献率达22.3%。本研究强调了土壤微生物代谢和残体对土壤稳定性有机碳固存的重要贡献。
研究背景:
土壤SOC是陆地生态系统中最大的C库,其动态变化直接影响全球C平衡。土壤C和氮(N)循环紧密耦合,并很大程度上受气候变化和人类活动的影响。长期施肥增加了土壤养分有效性,并显著地影响土壤C动态。尽管施肥具有增加土壤C储量的潜力,但就长期而言,土壤C稳定性取决于未来气候变化。土壤有机碳对长期施肥的响应程度和方向受温度和降水的影响。根据农业生态系统的长期野外观测和模型模拟,发现土壤养分和气候因子的交互影响决定了32%土壤有机碳的变异,并与微生物代谢、酶活性和残体微生物周转密切相关。
土壤微生物不仅能分解土壤有机质,还能代谢植物残体或通过合成代谢形成残体来稳定土壤C。微生物残体通常与土壤矿物质表面紧密结合而形成相对稳定的C。土壤微生物碳泵理论表明,微生物通过体外修饰(ex vivo modification)和体内周转(in vivo turnover)来调节土壤碳的积累。这意味着作为难降解C源,微生物代谢产物或残体对有机碳的贡献很大,而养分或易降解C的添加也可以长期增加土壤有机质。这一过程受到多因素环境变化的强烈影响。因此,需要进一步研究不同气候条件和长期施肥下微生物生理代谢和残体对土壤碳的贡献,以更好地理解农业土壤有机碳的积累和稳定性。
主要结果:
1. 施肥对不同气候条件下SOC数量与质量的影响
土壤移置12年后,在较温暖的气候条件下,SOC的损失显著减少(TransS2处理)(Fig. 1a)。施肥显著提高了TransS2处理下土壤顽抗性碳组分(RC)中的芳香C含量,其芳香度指数是Trans S2处理的2.7倍 (Fig. 1a, b),表明了在温暖的气候条件下,施肥促进了腐殖化过程。对于土壤活性C组分(LC)而言,气候变暖条件下未施肥土壤中氧烷基C和羰基C降低,而施肥显著减缓了LC的损失。TransS2处理土壤在施肥后烷基/氧烷基C比率的降低(Fig. 1b)表明了施氮对易分解C的消耗具有潜在抑制作用。
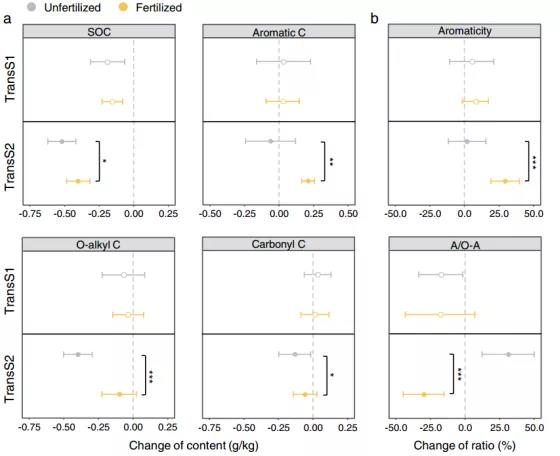
图1 土壤移置12年后,不同气候条件下施肥对土壤有机碳及其分子群的影响。a代表在不同气候条件下(TransS1表示寒温带土壤移至暖温带;TransS2表示寒温带土壤移至亚热带)施肥对SOC以及其分子类群(烷基C,O-烷基C,缩醛C,芳香C和羰基C)的影响;b中A/O-A%(%)=烷基C峰面积(0-45 ppm)/O-烷基C峰面积(45-90 ppm)*100%,芳香性程度(%)=芳香C峰面积(110-160 ppm)/总峰面积(0-160 ppm)*100%。图中*,**,***分别代表p < 0.05,p < 0.01和***p < 0.001。
2. 活细菌群落和总微生物群落组成和结构的变化
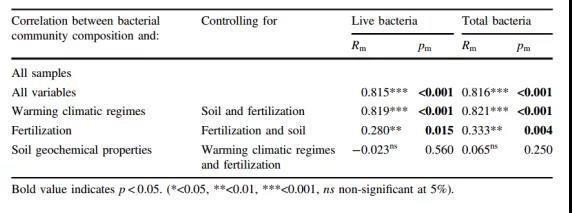
施肥显著改变了不同气候条件下细菌群落的组成和结构(Fig. 2a), 增加活细菌α-多样性,降低总细菌α-多样性。与土壤地球化学属性的影响相比,施肥和气候因子(MAT和MAP)是改变活微生物群落结构和总微生物群落结构的主导因素(Table 1)。
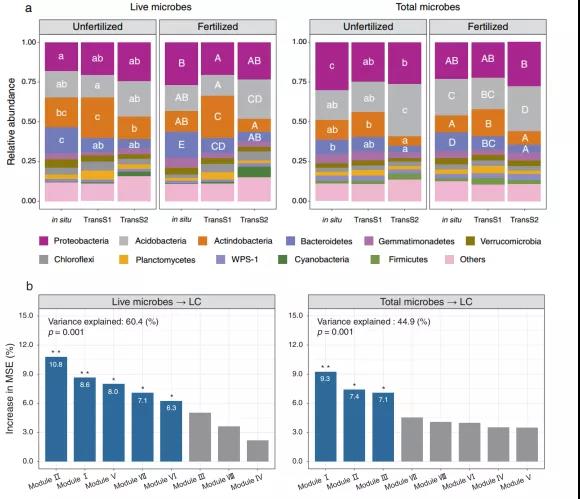
Fig. 2 活微生物和总微生物的群落组成及模块化分析。a代表活细菌群落和总细菌群落组成的比较,图中仅显示了相对丰度排名前十的细菌门,其他细菌门均表示为“其他门”;b基于随机森林模型,在活微生物和总微生物中排名前八的网络模块对土壤不稳定碳(LC)成分变化的贡献。
Table 1 微生物群落组成与土壤理化性质(pH,SOC,TN,TP,NO3--N, NH4+-N),气候条件变化和施肥之间Mantel及偏Mantel检验。
3. 活微生物/总微生物比与土壤易分解碳和顽固性碳之间的关系
随机森林模型中有5个活微生物模块和3个总微生物模块对LC变化有显著贡献,解释率分别为60.4%和44.9%(Fig. 2b)。总微生物对RC的贡献率(78.81%)高于活微生物(70.69%) (Fig. 2b)。
4. 活微生物对碳组分贡献的实验分析
通过Raman-D2O法研究了活细菌的代谢活性,确定其在土壤移植后的降解能力(Fig. 3)。采用不同的基质(淀粉和纤维素)以及D2O培养细菌,其培养物在2040~2300 cm-1范围内表现出明显的C -D拉曼谱带。以淀粉为C源的情形下, TransS1和TransS2的C-D/(C-D + C-H)比值显著高于原位处理,而以纤维素为C源的情形下则趋势相反。
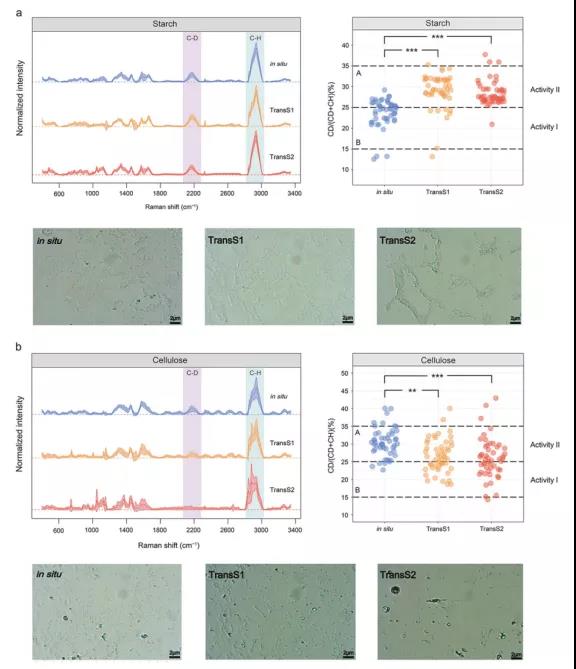
Fig. 3 在施肥土壤中,以D2O同位素标记同时结合单细胞Raman光谱技术探究不同碳源培养条件下土壤微生物的代谢活性。a 左侧代表拉曼光谱,右侧代表 C-D比率(C-D/(C-D+C-H))以及在50% D2O的无机盐+淀粉培养基中培养24h后土壤细菌的拉曼mapping图;b代表拉曼光谱,C-D比率以及在无机盐+纤维素培养基中培养的土壤细菌的拉曼mapping图;**和***分别代表p < 0.01和p < 0.001。
施肥显著降低了TransS2中土壤α-和β-葡萄糖苷酶活性(Fig. 4a)。通过接种土壤悬浮液测试活体微生物对不同C源(淀粉和纤维素)分解能力的实验显示施肥显著降低了淀粉和纤维素分解所产生的CO2(Fig. 4b),这表明施肥减少了TransS2土壤不稳定碳和稳定碳的损失。此外,分别绘制了活细菌在淀粉和纤维素中的生长曲线(Fig. 4c)。在较温暖的气候条件下,施肥土壤中细菌的生长活性低于未施肥土壤。特别是在以淀粉为碳源的情况下,施肥土壤中的细菌加速进入稳定期,而未施肥土壤中的细菌持续生长。
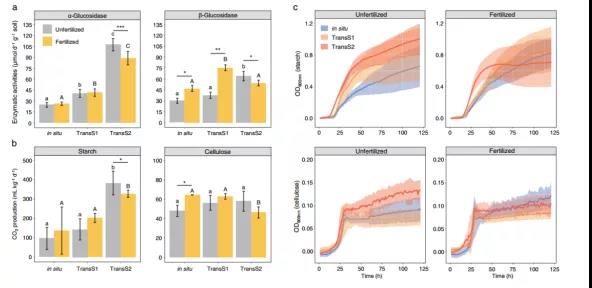
Fig. 4 不同气候条件下施肥对不同碳源的土壤微生物代谢能力和生长的影响。a代表土壤酶活性(α-和β-葡萄糖苷酶);b代表微生物降解淀粉和纤维素能力的微环境实验;c代表以淀粉和纤维素为C源培养条件下活的土壤微生物的生长曲线(n=9)。
5. 基于氨基糖分析探究微生物残体对SOC 的贡献
在TransS2处理下,施肥显著增加微生物残体含量(Fig. 5a)。土壤移置12年后,微生物死生物质的积累增加。采用偏RDA方法估算了土壤中活体微生物和死微生物以及土壤地球化学属性对LC和RC组分的贡献(Fig. 5b):活细菌对LC组分的贡献率为30.9%,远高于死微生物对LC组分的贡献率(1.1%)。死亡微生物对RC组分的贡献率为22.3%,高于活微生物(6.4%),表明了微生物残体可能是土壤RC的主要贡献者。
基于微生物 C泵理论,微生物代谢产物或残体可以对RC-SOC有很大的贡献,这强调微生物在碳吸存过程中的调节作用。本研究构建了一个概念框架,以揭示在氮缺乏和充足的情况下,微生物生理代谢和残体调控SOC吸存的潜在作用机制(图6)。在温暖气候条件下,施肥可通过促进微生物残体的积累来补充土壤中的顽固性碳(芳香族C),同时降低活微生物对不稳定的C组分的消耗来增加土壤C吸存。
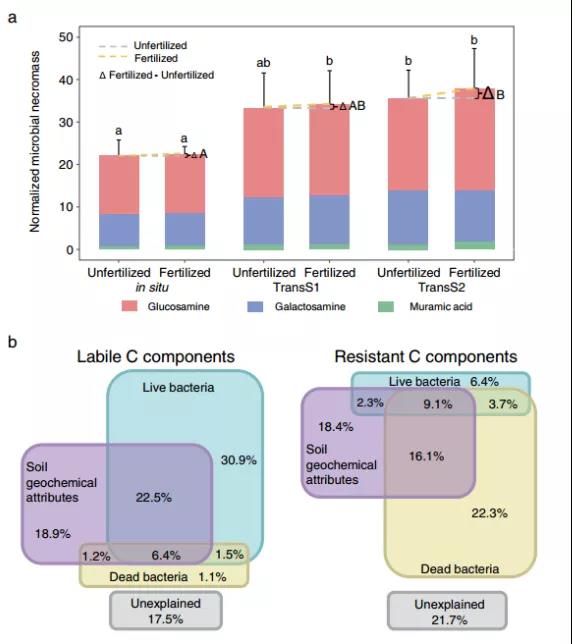
Fig. 5 微生物死生物质对土壤SOC的贡献。a代表作为微生物残体生物标志物的土壤氨基糖含量,包括来自死真菌的氨基葡萄糖和来自死细菌的氨基半乳糖和胞壁酸,大写字母表示不同气候条件下施肥效应具有显著差异,小写字母表示原位与移栽之间具有显著差异;b代表土壤地球化学性质、活细菌生物量和细菌氨基糖含量对土壤LC和RC影响的偏冗余分析(pRDA)。
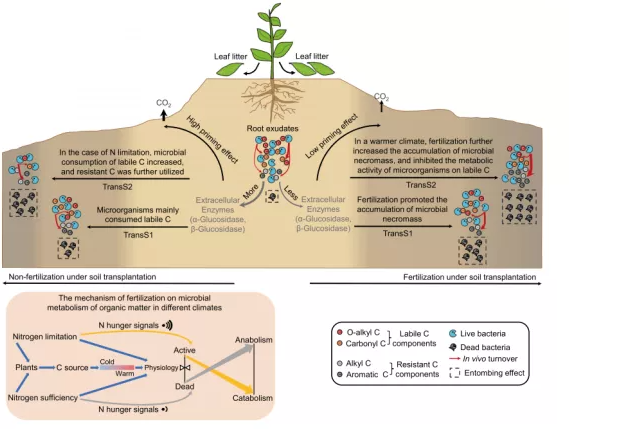
Fig. 6不同气候条件下施肥与非施肥土壤微生物对有机碳分子群的潜在调控机制示意图。上图中土壤颜色梯度反映了LC和RC分量的变化,高度代表了SOC的含量。左下图表示了不同气候条件下氮素限制或充足对微生物SOC代谢的影响机制。在不施肥的情况下,由于氮素的限制,植物和微生物可能会发出更强的氮饥饿信号,微生物产生更多的胞外酶分解有机碳以获得氮源。此外,氮素缺乏减少了植物根系分泌物(易于降解的碳源)的输入,增温加速了土壤中不稳定碳的消耗,进一步刺激了土壤中微生物呼吸对稳定碳的利用,导致土壤有机碳的减少。在施肥情况下,土壤微生物残体的增加补充了土壤不稳定碳,低氮饥饿信号降低了微生物对土壤稳定碳的消耗。
