摘要:
最近的研究强调,真菌菌丝残体是土壤C和N输入和储存的重要组成部分。因此,识别控制真菌残体分解的微生物群落和生态因子将为了解真菌有机质如何影响森林土壤C和养分循环提供关键的见解。我们调查了真菌残体上定殖的微生物群落的长期动态过程,利用不同网孔大小的培养袋以控制植物根系和微生物分解者的参与。在30个月的培养过程中,残体相关的细菌和真菌群落在分类和功能上都很丰富,寡营养细菌和根相关真菌(即ECM真菌、ERM真菌和内生真菌)的丰度在网袋分解后期增加。残体相关的β-葡萄糖苷酶活性在6个月时最高,而亮氨酸氨基肽酶在18个月时最高。基于渐近分解模型,根的存在与真菌残体最初更快的分解速率有关,但导致在稍后的采样时间内真菌残体保留的更多。这些结果表明,微生物群落组成和酶活性在分解真菌残体过程中保持动态变化,根系及其共生真菌导致微生物残体周转随着时间的推移而减慢。
关键词:
细菌,北方森林土壤,C循环,ECM真菌,ERM真菌,真菌残体,真菌,菌丝周转。
研究背景:
死亡的真菌菌丝(以下简称真菌残体)在土壤C、N循环中发挥着重要的作用。但迄今为止的大多数研究集中于短期的真菌残体质量损失以及与残体分解相关的早期定殖的微生物群落。考虑到真菌残体较难降解部分的长期存在,微生物分解者在何种程度上仍然活跃地占据这些部分尚不清楚。此外,很少有研究测量了与真菌残体分解相关的酶,这与基于序列的鉴定可以帮助确定不同微生物分解者群体的目标资源。最后,根系可以加速或延缓土壤有机质的分解。并且根系的存在也会影响各种与根系相关的微生物丰度,包括ECM真菌。然而目前尚不清楚随着时间的推移与根系相关的ECM真菌是如何影响真菌残体的。
研究内容:
基于此,本研究对含有真菌残体的网袋首先进行了高通量测序来识别6、18和30个月土壤培养后与真菌残体分解相关的细菌和真菌群落。其次,在同一采样时间内,定量了3种针对不同的C和N组分的酶(β-葡萄糖苷酶、亮氨酸氨基肽酶和N-乙酰葡萄糖苷酶)的活性。第三,重新分析了真菌残体质量损失率,以评估早期和后期取样时根系存在的潜在不同影响。
研究方法:
本研究在赫尔辛基大学Hyytiälä林业野外观测站和SMEAR II生态-大气关系测量站进行。将原位培养的Chondrostereum purpureum残体放入3种不同孔径(1、50、1000μm)的尼龙网袋中,再将网袋随机埋入有机层和矿质层之间,并于分解的第6、18和30个月时收获。
研究结果:
细菌OTU丰富度随时间增加相对稳定,而真菌群落的OTU丰富度随时间增加而增加(图1)。此外,细菌和真菌群落的OTU丰富度随着网孔的减小而显著降低。
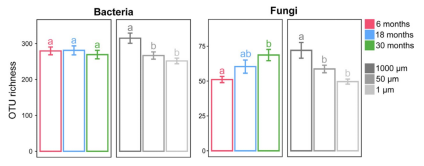
图1 不同培养时间或网孔大小的细菌和真菌的OTU丰富度;不同小写字母表示有统计学意义(p ≤0.05)
NMDS分析显示,与1000μm网袋上的定殖的细菌群落相比,50μm和1μm的细菌群落更为相似(图2a)。培养时间是控制细菌群落结构的主要因素,解释了20.3%的OTU组成变化(图2b)。细菌群落主要由Acidobacteria、Actinobacteria、Alphaproteobacteria、Gammaproteobacteria、Bacilli、Bacteroidia和Verrucomicrobiae等组成(图2c)。Alphaproteobacteria、Gammaproteobacteria、Bacteroidia是培养6个月后最丰富的纲,Acidobacteriia、Actinobacteria、Bacilli和 Verrucomicrobiae培养30个月后逐渐成为占优势的纲。另外,50 μm和1 μm的真菌群落也更为相似(图2d)。培养时间和孔径显著影响真菌群落组成,解释了OTU组成变化的5.7%和4.5%(图2e)。在所有采样时间点,真菌群落以Mucoromycetess纲(高达75%)为主,其次是Agaricomycetes、Eurotiomycetes、Leotiomycetes纲(图2f)。在1000 μm菌袋中,Mucoromycetess的相对丰度随时间的延长而减少,而在50 μm和1 μm菌袋中,Mucoromycetess的相对丰度在整个实验过程中仍占主导地位
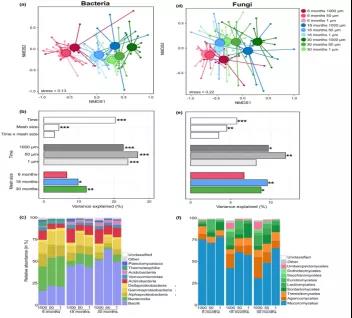
图2 不同培养时间和网孔径大小的OTU组成的(a)细菌和(d)真菌群落的非度量多维尺度(NMDS)分析。不同培养时间和网孔径大小的基于排列多变量方差分析(PERMANOVA)解释(b)细菌和(e)真菌OTU组成的方差,培养时间和网孔大小单独处理。不同培养时间和网孔径大小的(c)细菌和(f)真菌纲相对丰度。
在三个采样时间,定殖的细菌派系总体以富营养细菌为主(图3a)。然而,培养时间显著影响富营养细菌和寡营养细菌相对丰度(表S4),前者随着时间的推移从60%下降到20%,后者从6个月时的2.5%上升到30个月时的8%(图3a)。另外,定殖的真菌派系中腐生菌占据主导地位(图3b)。腐生真菌的相对丰度随时间增加而减少,ECM真菌和ERM真菌的相对丰度随时间增加而显著增加。腐生真菌的相对丰富度随孔径减小而增加,ECM真菌、ERM真菌和内生真菌的相对丰富度随孔径减小而减少(图3b)。
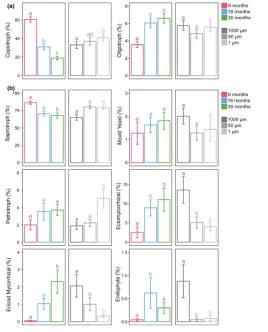
图3 不同培养时间或网孔大小的(a)细菌和(b)真菌功能群的相对丰度;不同小写字母表示有统计学意义(p ≤0.05)
大部分细菌属受到培养时间的显著影响(图4)。Chitinophaga、Dokdonella、Ferruginibacter、Mucilaginibacter和Pedobacter在培养6个月后是最丰富的细菌属,然后在整个实验过程中下降。在收获6个月时,Bacillus、Cohnella、Granulicella、Mycobacterium和Paenibacillus等细菌属含量不高,但在18和30个月时显著增加。与50和1 μm孔径处理相比,1000 μm孔径处理中Acidothermus、Bradyrhizobium、Burkholderia、Cohnella和Mycobacterium属显著富集。Cohnella、Labilithrix、Paenibacillus和Rhodococcus相对丰度与真菌残体残留量呈显著负相关。Acidipila、Dyella、Flavobacterium、Streptacidiphilus和Streptomyces的相对丰度与真菌残体残留量呈显著正相关。
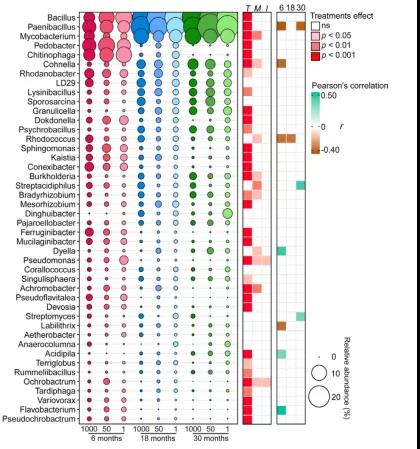
图4 不同培养时间或网孔大小的细菌属的相对丰度。其中细菌属较为丰富,占总相对丰度的80%。圆的大小与每个细菌属的相对丰度有关。采用双因素方差分析评价了培养时间和网孔大小对各细菌属相对丰度的影响,p值用红色表示(T =时间,M =网孔大小,I =时间×网孔大小);ns表示结果不显著。不同采样时间细菌属相对丰度与真菌残体质量之间的Pearson相关性。只显示了显著的相关性(p ≤0.05)
在整个试验过程中,Mucor是最丰富的真菌属,但在后期显著减少(图5)。在18和30个月的采样次数中,1000 μm真菌袋中的Mucor相对丰度也显著低于50和1 μm真菌袋。第二丰富的Penicillium属在50 μm真菌袋中的含量显著高于1000 μm和1 μm真菌袋。此外,Geomyces、Inocybe、Meliniomyces和Penicillium在6个月的采样时间内与真菌残体质量残留量呈显著正相关,而Amanita, Mortierella, 、Piloderma和Umbelopsis 在后期采样时间内与真菌残体质量残留量呈正相关。
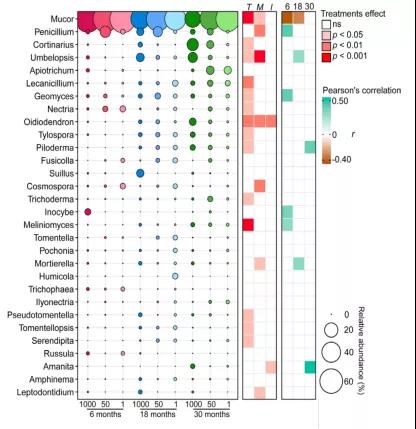
图5 不同培养时间或网孔大小的真菌属的相对丰度。其中真菌属较为丰富,占总相对丰度的80%。圆的大小与每个真菌属的相对丰度有关。采用双因素方差分析评价了培养时间和网孔大小对各真菌属相对丰度的影响,p值用红色表示(T =时间,M =网孔大小,I =时间×网孔大小);ns表示结果不显著。不同采样时间真菌属相对丰度与真菌残体质量之间的Pearson相关性。只显示了显著的相关性(p ≤0.05)
β-葡萄糖苷酶活性受培养时间显著影响, 6个月时高于18个月或30个月时的活性(图6)。亮氨酸氨基肽酶活性也受培养时间的显著影响,18个月后达到最大值。相比之下,乙酰氨基葡萄糖苷酶活性不受培养时间的显著影响。三种酶活性均不受孔径处理的显著影响(图6)。
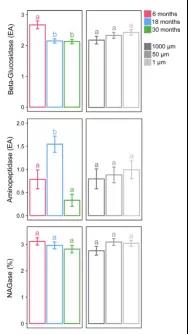
图6 不同培养时间或网孔大小的酶活性;不同小写字母表示有统计学意义(p ≤0.05)
渐近衰减模型显示真菌残体的质量损失取决于孔径大小和时间。与1000 μm菌袋(k = 5.65)相比,50 μm菌袋和1 μm菌袋的衰变常数(k = 0.43和k = 0.50)相对较低。1000 μm菌袋的渐近值是50 μm或1 μm菌袋的1.5倍,这与后期质量损失相关。在第二次和第三次采收中,1000 μm真菌袋中残留的质量稳定在~12%,而50 μm和1 μm真菌袋中残留的质量稳定在~7%(图S4,表S6)。
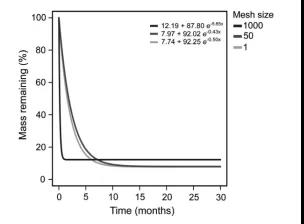
图7 渐近非线性指数衰减模型适用于各种网格尺寸的处理
原名:Root presence modifies the long-term decomposition dynamics of fungal necromass and the associated microbial communities in a boreal forest
译名:北方森林中根系的存在改变了真菌残体和相关微生物群落的长期分解动态
期刊:Molecular Ecology
IF:5.163
发表时间:2021.01.26
第一作者: François Maillard
通讯作者:François Maillard
合作作者:Peter G. Kennedy, Bartosz Adamczyk, Jussi Heinonsalo, Marc Buée
主要单位:
INRAE, UMR IAM, Université de Lorraine, Nancy, France
Department of Plant and Microbial Biology, University of Minnesota, St. Paul, MN, USA Natural Resources Institute Finland, Helsinki, Finland
Department of Microbiology, University of Helsinki, Helsinki, Finland
Institute for Atmospheric and Earth System Research (INAR)/Forest Sciences, University of Helsinki, Helsinki, Finland
Finnish Meteorological Institute, Helsinki, Finland